题目内容
11.W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素.(1)W、X的最高价氧化物对应的水化物可以反应生成某复杂化合物,该离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(2)W与Y可形成化合物W2Y,该化合物的电子式为
 .
.(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl.
(4)比较Y、Z气态氢化物的稳定性:HCl>H2S(用化学式表示).
(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是S2->Cl->Na+>Al 3+.
分析 W、X、Y、Z是原子序数依次增大的同一周期元素,W、X是金属元素,Y、Z是非金属元素,
(1)W、X各自的氧化物对应的水化物可以反应生成盐和水,可推知W为Na、X为Al;
(2)W(Na)与Y可形成化合物W2Y,Y表现-2价,则Y为S;
(3)结合原子序数可知Z为Cl,S的低价氧化物通入氯气的水溶液中,应为二氧化硫与氯气反应生成硫酸与HCl;
(4)同周期自左而右元素非金属性正确,非金属性越强,氢化物越稳定;
(5)半径的比较:一看电子层数,电子层数越多,半径越大,二看核电核数,电子层数相同的情况下,半径随原子序数的增大而减小.
解答 解:W、X、Y、Z是原子序数依次增大的同一周期元素,原子序数均小于18,W、X是金属元素,Y、Z是非金属元素,
(1)W、X为金属,其最高价氧化物对应的水化物为碱,且两种碱可以反应生成盐和水,则为NaOH和Al(OH)3,二者反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)W(Na)与Y可形成化合物W2Y,Y表现-2价,则Y为S,Na2S的电子式为: ,
,
故答案为: ;
;
(3)结合原子序数可知Z为Cl,S的低价氧化物通入氯气的水溶液中,应为二氧化硫与氯气反应生成硫酸与HCl,反应化学方程式为:SO2+Cl2+2H2O=H2SO4+2HCl,
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl;
(4)氢化物的稳定性与非金属性有关,非金属性越强,其氢化物越稳定,同周期从左向右,非金属性增强,即Cl>S,则氢化物稳定性:HCl>H2S,
故答案为:HCl>H2S;
(5)电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径大小顺序是:S 2->Cl->Na+>Al 3+,
故答案为:S2->Cl->Na+>Al 3+.
点评 本题考查原子结构与元素周期律的关系,涉及电子式、半径比较、热化学方程式书写等知识,题目难度中等,正确推断元素是解本题关键,注意掌握微粒半径大小的比较方法.

| A. | 溶液的pH<7 | B. | 得到澄清透明溶液 | ||
| C. | 得到浑浊液 | D. | 先有白色沉淀生成,后逐渐溶解 |
| A. | 某放热反应能自发进行,因此该反应是熵增反应 | |
| B. | 用惰性电极电解含有 H218O的普通水时,阳极可能产生两种相对分子质量不同的氧分子 | |
| C. | 反应 A(g)?B(g)△H,若正反应的活化能为 EakJ/mol,逆反应的活化能为 EbkJ/mol,则△H=-(Ea-Eb)kJ/mol | |
| D. | 3x%的 A 物质的溶液与 x%的 A 物质的溶液等体积混合后溶液质量分数小于 2x%,则 A 可 能为乙醇 |
| A. | 向0.10mol•L-1氨水中通SO2:c(NH4+)+c(NH3•H2O)═c(HSO3-)+c(SO32-)+c(H2SO3) | |
| B. | 向0.10mol•L-1KHSO3溶液中通NH3:c(K+)>c(SO32-)>c(NH4+) | |
| C. | 向0.10mol•L-1NH4HS溶液中通H2S:c(NH4+)═c(S2-)+c(HS-) | |
| D. | 向0.10mol•L-1Na2C2O4溶液中通HCl:c(Cl-)═c(HC2O4-)+2c(H2C2O4) |
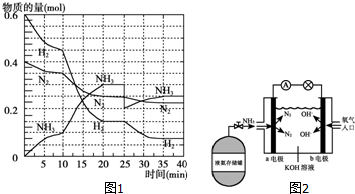 氨在工农业生产中应用广泛.德国人哈伯发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图1所示:
氨在工农业生产中应用广泛.德国人哈伯发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图1所示:
 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用图1装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用图1装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.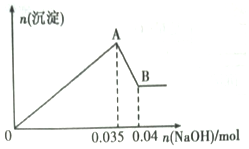 某无色工业废水中可能含有Na+、Mg2+、Al3+、Cu2+、Cl-、SO42-中的几种离子.
某无色工业废水中可能含有Na+、Mg2+、Al3+、Cu2+、Cl-、SO42-中的几种离子.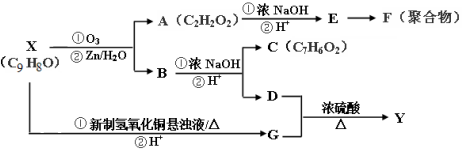
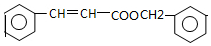 .
.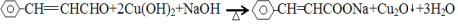 .
.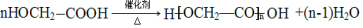 .
. .
.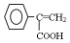 ,写出以
,写出以 为有机原料,制取H的合成路线(可任选无机原料).
为有机原料,制取H的合成路线(可任选无机原料).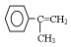 →
→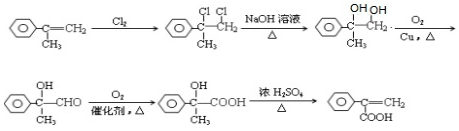 .
.