题目内容
16.某无色溶液,其中可能存在如下离子:Na+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-,现取该溶液进行有关实验,结果如图所示.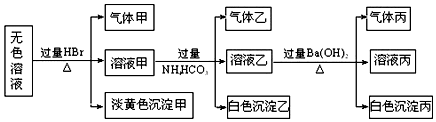
(1)生成沉淀甲的离子方程式为2S2-+SO32-+6H+=3S↓+3H2O.
(2)由溶液甲生成沉淀乙的离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑.
(3)沉淀丙可能是BaCO3或BaCO3与BaSO4的混合物,请设计化学实验确定其成分在所得沉淀丙中加入稀盐酸,若沉淀全部溶解,说明沉淀丙是BaCO3,若沉淀仅部分溶解,说明沉淀是BaCO3和BaSO4的混合物.
(4)综合上述信息,可以肯定存在的离子有Na+、S2-、SO32-、AlO2-,一定不存在的离子是Ba2+、Al3+.
分析 由无色溶液加HBr产生淡黄色沉淀,该沉淀只能为S,则发生2S2-+SO32-+6H+=3S↓+3H2O,说明一定存在S2-、SO32-,根据离子共存可知一定不存在Ba2+、Al3+;CO32-和SO42-可能存在,根据溶液要呈电中性,故Na+一定存在;白色沉淀乙应为原溶液中含有的AlO2-与过量HBr反应生成Al3+与HCO3-发生双水解得到Al(OH)3,气体乙为二氧化碳,再加过量Ba(OH)2反应,因NH4HCO3过量,白色沉淀丙一定含碳酸钡,还可能有BaSO4,气体丙为氨气,
(1)结合可能存在的离子知,加入HBr后得到淡黄色沉淀一定S2-与SO32-在酸性条件下发生归中反应得到的单质硫;
(2)由(1)知,溶液中含S2-与SO32-,则一定不含Ba2+、Al3+,加入过量NH4HCO3后得到白色沉淀只能是原溶液中含有的AlO2-与过量HBr反应生成Al3+与HCO3-发生双水解得到Al(OH)3;
(3)沉淀丙即可能是剩余NH4HCO3与Ba(OH)2反应得到BaCO3,也可能是BaCO3与溶液可能含有的SO42-与Ba(OH)2反应得到BaSO4的混合物;因硫酸钡不溶于盐酸,因此可利用加入盐酸,观察固体溶解情况来判断固体成分;
(4)结合前面分析知一定含有S2-、SO32-、AlO2-,在利用电荷守恒可知必含Na+; 一定不含Ba2+、Al3+; 无法确定是否含有CO32-、SO42-.
解答 解:由无色溶液加HBr产生淡黄色沉淀,该沉淀只能为S,则发生2S2-+SO32-+6H+=3S↓+3H2O,说明一定存在S2-、SO32-,根据离子共存可知一定不存在Ba2+、Al3+;CO32-和SO42-可能存在,根据溶液要呈电中性,故Na+一定存在;白色沉淀乙应为原溶液中含有的AlO2-与过量HBr反应生成Al3+与HCO3-发生双水解得到Al(OH)3,气体乙为二氧化碳,再加过量Ba(OH)2反应,因NH4HCO3过量,白色沉淀丙一定含碳酸钡,还可能有BaSO4,气体丙为氨气,
(1)沉淀甲为单质硫,生成S的反应是溶液中S2-与SO32-在酸性条件下发生归中反应得到,所以生成沉淀甲的离子方程式为:2S2-+SO32-+6H+=3S↓+3H2O,
故答案为:2S2-+SO32-+6H+=3S↓+3H2O;
(2)溶液中含S2-与SO32-,则一定不含Ba2+、Al3+,而溶液甲与过量NH4HCO3后得到白色沉淀一定是Al(OH)3,产生该沉淀的原因一定是原溶液中含有的AlO2-与过量HBr反应生成Al3+与HCO3-发生双水解得到Al(OH)3,所以生成沉淀乙的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)沉淀丙即可能是剩余NH4HCO3与Ba(OH)2反应得到BaCO3,也可能是BaCO3与溶液可能含有的SO42-与Ba(OH)2反应得到BaSO4的混合物,故沉淀丙可能是:BaCO3或BaCO3与BaSO4的混合物;利用碳酸钡可溶于盐酸而硫酸钡不溶于盐酸的性质,利用向固体中加入盐酸,观察固体溶解情况来判断固体成分,故确定固体成分的方法是:在所得沉淀丙中加入稀盐酸,若沉淀全部溶解,说明沉淀丙是BaCO3,若沉淀仅部分溶解,说明沉淀是BaCO3和BaSO4的混合物,
故答案为:BaCO3或BaCO3与BaSO4的混合物;在所得沉淀丙中加入稀盐酸,若沉淀全部溶解,说明沉淀丙是BaCO3,若沉淀仅部分溶解,说明沉淀是BaCO3和BaSO4的混合物;
(4)根据分析可知一定含有离子为:S2-、SO32-、AlO2-、Na+; 一定不含的离子为:Ba2+、Al3+; 无法确定是否含有的离子为:CO32-、SO42-,
故答案为:Na+、S2-、SO32-、AlO2-;Ba2+、Al3+.
点评 本题考查无机推断,题目难度中等,涉及离子推断、离子方程式书写、物质检验方案的设计等知识,明确常见离子的性质为解答关键,试题有利于提高学生的分析、理解能力及逻辑推理能力.

| A. | 原子半径:A<B<C | |
| B. | 三种元素的最高价氧化物对应水化物均可由化合反应得到 | |
| C. | A的氢化物稳定性小于C的氢化物稳定性 | |
| D. | B 和A的最高价氧化物可发生置换反应 |
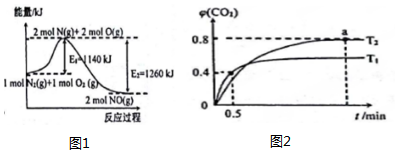
Ⅰ.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:CO(g)+H2O(g)?CO2(g)+H2(g)
(1)向1L恒容密闭容器中充人CO和H2O(g),800℃时测得部分数据如下表.
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
(2)相同条件下,向2L恒容密闭容器中充入1molCO、1mol H2O(g)、2molCO2、2mo1H2,
此时υ(正)< υ(逆)(填“>”“=”或“<”).
(3)一定温度下,在恒容密闭容器中NO2与O2反应如下:4NO2(g)+O2(g)?2N2O5(g);若已知K350℃<K300℃,则该反应是放热反应(填“吸热”或“放热”).
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1
(4)利用CO、H2合成液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=-129kJ•mol-1.
(5)依据化学反应原理,分析增加压强对制备甲醇反应的影响增加压强使反应速率加快,同时平衡右移,CH3OH产率增大.
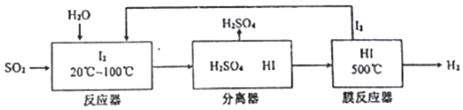
Ⅲ.为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:

一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O${\;}_{2}^{-}$
(6)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式C8H18-50e-+25O2-=8CO2+9H2O.
(7)已知一个电子的电量是1.602×10-19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH80g.
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一.
(8)将CO2转化成有机物可有效地实现碳循环.如:
a.6CO2+6H2O$\stackrel{光照/叶绿素}{→}$C6H12O6+6O2
b.2CO2+6H2$→_{△}^{催化剂}$C2H5OH+3H2O
c.CO2+CH4$→_{△}^{催化剂}$ CH3COOH
d.2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2O
以上反应中,最节能的是,反应c中理论上原子利用率为100%.
| A. | 向水中加入少量的CH3COONa | B. | 向水中加入少量的NaHSO4 | ||
| C. | 加热水至100℃,pH=6 | D. | 向水中加少量的明矾 |
| A. | 0.5mol/L | B. | 0.05mol/L | C. | 0.4mol/L | D. | 0.01mol/L |
 .
.