��Ŀ����
20��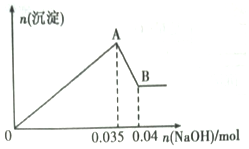 ij��ɫ��ҵ��ˮ�п��ܺ���Na+��Mg2+��Al3+��Cu2+��Cl-��SO42-�еļ������ӣ�
ij��ɫ��ҵ��ˮ�п��ܺ���Na+��Mg2+��Al3+��Cu2+��Cl-��SO42-�еļ������ӣ�a��ȡ0.1mL�÷�ˮ�ڹ��У�����������Ba��N03����Һ��ϡ���ᣬ������ɫ��������ַ�Ӧ����ˣ�����Һ�м���AgNO3��Һ����������
b����ȡ10mL�÷�ˮ�ڹ��У��μ�NaOH��Һ�Ȳ�����ɫ�������ֳ����ܽ⣮���ɳ��������ʵ��������NaOH���ʵ�����ϵ��ͼ��ʾ��
��������ʵ���ͼ�����ݣ�
��1���÷�ˮ��һ�������е�������Cu2+��Cl-�������ӷ��ţ���
��2��ʵ��������100mL mol•L-1��NaOH��Һʱ���õ��IJ����������ձ�������������Ͳ�⣬����Ҫ100mL����ƿ����ͷ�ιܣ����������ƣ���
��3��д��A��B�����з�����Ӧ�����ӷ���ʽ��Al��OH��3+OH-=AlO2-+H2O��
��4���÷�ˮ�У�c��Al3+��=0.5mol/L��
���� ��ɫ��Һ�в��������ɫ��Cu2+��
a��ȡ0.1mL�÷�ˮ�ڹ��У�����������Ba��NO3����Һ��ϡ���ᣬ������ɫ�������ó���Ϊ���ᱵ����ԭ��Һ�к���SO42-����ַ�Ӧ����ˣ�����Һ�м���AgNO3��Һ����������˵��ԭ��Һ�в�����Cl-��
b����ȡ10mL�÷�ˮ�ڹ��У��μ�NaOH��Һ�Ȳ�����ɫ�������ֳ����ܽ⣬�ܽ�ij���Ϊ�������������ܵij���Ϊ������þ����ԭ��Һ��һ������Mg2+��Al3+��
�������Ϸ������н��
��� �⣺��ɫ��Һ�в��������ɫ��Cu2+��
a��ȡ0.1mL�÷�ˮ�ڹ��У�����������Ba��NO3����Һ��ϡ���ᣬ������ɫ�������ó���Ϊ���ᱵ����ԭ��Һ�к���SO42-����ַ�Ӧ����ˣ�����Һ�м���AgNO3��Һ����������˵��ԭ��Һ�в�����Cl-��
b����ȡ10mL�÷�ˮ�ڹ��У��μ�NaOH��Һ�Ȳ�����ɫ�������ֳ����ܽ⣬�ܽ�ij���Ϊ�������������ܵij���Ϊ������þ����ԭ��Һ��һ������Mg2+��Al3+��
��1�����ݷ�����֪���÷�ˮ��һ�������е������У�Cu2+��Cl-��
�ʴ�Ϊ��Cu2+��Cl-��
��2��ʵ��������100mL mol•L-1��NaOH��Һʱ���õ��IJ����������ձ�������������Ͳ�⣬����100mL��Һ����ѡ�ù��Ϊ100mL������ƿ������ʱ����ʹ�ý�ͷ�ιܣ�
�ʴ�Ϊ��100mL����ƿ����ͷ�ιܣ�
��3��A��B����Ϊ�����������������Ʒ�Ӧ����ƫ�����ƺ�ˮ����Ӧ�����ӷ���ʽΪ��Al��OH��3+OH-=AlO2-+H2O��
�ʴ�Ϊ��Al��OH��3+OH-=AlO2-+H2O��
��4�����ݷ�ӦAl��OH��3+OH-=AlO2-+H2O��֪��n[Al��OH��3]=n��NaOH��=0.04mol=0.035mol=0.005mol�����������غ��֪ԭ��Һ�������ӵ����ʵ���Ϊ0.005mol����ԭ��Һ�������ӵ�Ũ��Ϊ��c��Al3+��=$\frac{0.005mol}{0.01L}$=0.5mol/L��
�ʴ�Ϊ��0.5mol/L��
���� ���⿼���˳������ӵļ��鷽������Ŀ�Ѷ��еȣ��漰�����ƶϡ���Һ���ơ����ʵ���Ũ�ȵļ��㡢���ӷ���ʽ��д��֪ʶ����ȷ�����������仯��������Ϊ���ؼ�������������ѧ���ķ���������������������

 53���ò�ϵ�д�
53���ò�ϵ�д�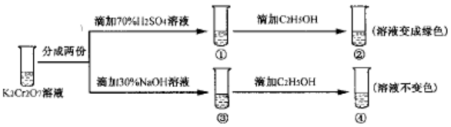
| A�� | ������Һ��ƣ�������Һ��ɫ���� | |
| B�� | �������淴Ӧ��ƽ�ⳣ�����٣��� | |
| C�� | K2Cr2O7��Һ�������������������¸�ǿ | |
| D�� | ������м���70%H2SO4��Һ����������Һ��Ϊ��ɫ |
 ��
��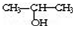 ��NaOH�Ĵ���Һ�����Ʊ�CH3-CH�TCH2
��NaOH�Ĵ���Һ�����Ʊ�CH3-CH�TCH2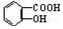 ������NaHCO3��Һ��Ӧ�Ʊ�
������NaHCO3��Һ��Ӧ�Ʊ�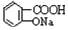
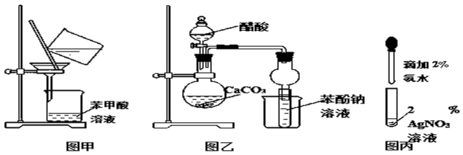
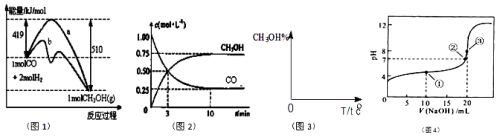
 ��ͼ��ij��ʵ��̽�������仯�������ʵ�����ͼ��
��ͼ��ij��ʵ��̽�������仯�������ʵ�����ͼ��