题目内容
9.室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )| A. | 向0.10mol•L-1氨水中通SO2:c(NH4+)+c(NH3•H2O)═c(HSO3-)+c(SO32-)+c(H2SO3) | |
| B. | 向0.10mol•L-1KHSO3溶液中通NH3:c(K+)>c(SO32-)>c(NH4+) | |
| C. | 向0.10mol•L-1NH4HS溶液中通H2S:c(NH4+)═c(S2-)+c(HS-) | |
| D. | 向0.10mol•L-1Na2C2O4溶液中通HCl:c(Cl-)═c(HC2O4-)+2c(H2C2O4) |
分析 A.向0.10mol•L-1氨水中通SO2,溶液PH=7,溶液中若为c(NH4+)+c(NH3•H2O)═c(HSO3-)+c(SO32-)+c(H2SO3),物料守恒分析,则溶质为NH4HSO3,溶液不是中性;
B.溶液中钠离子与S原子物质的量之比为1:1,而铵根离子与部分亚硫酸根结合,由物料守恒可知,c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),溶液呈中性,由电荷守恒可得:c(K+)+c(NH4+)=2c(SO32-)+c(HSO3-),联立判断;
C.向0.10mol•L-1NH4HS溶液中通H2S后溶液中存在电荷守恒;
D.向0.10mol•L-1Na2C2O4溶液中通HCl,原溶液中存在物料守恒,c(Na+)=2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4),通入HCl后溶液电荷守恒分析计算;
解答 解:A.向0.10mol•L-1氨水中通SO2,溶液PH=7,溶液中若为c(NH4+)+c(NH3•H2O)═c(HSO3-)+c(SO32-)+c(H2SO3),则溶质为NH4HSO3,溶液显酸性,故A错误;
B.溶液中钾离子与S原子物质的量之比为1:1,而铵根离子与部分亚硫酸根结合,故c(Na+)>c(NH4+),由物料守恒可知,c(K+)=c(SO32-)+c(HSO3-)+c(H2SO3),溶液呈中性,由电荷守恒可得:c(K+)+c(NH4+)=2c(SO32-)+c(HSO3-),联立可得:c(NH4+)+c(H2SO3)=c(SO32-),c(K+)>c(SO32-)>c(NH4+),故B正确;
C.向0.10mol•L-1NH4HS溶液中存在电荷守恒,c(NH4+)+c(H+)═2c(S2-)+c(HS-)+c(OH-),通H2S后溶液PH=7,c(NH4+)═2c(S2-)+c(HS-),故C错误:
D.向0.10mol•L-1Na2C2O4溶液中通HCl,原溶液中存在物料守恒,c(Na+)=2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4),通入HCl后溶液电荷守恒:c(H+)+c(Na+)=2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-),带入计算得到c(Cl-)═c(HC2O4-)+2c(H2C2O4),故D正确;
故选BD.
点评 本题考查了电解质溶液中物理守恒、电荷守恒、离子浓度大小比较、化学反应后溶液酸碱性判断,掌握经常是解题关键,题目难度中等.

| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| D | 溴苯(溴单质) | 苯 | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
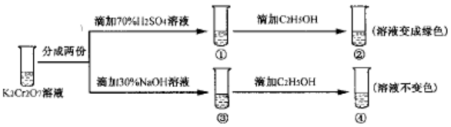
| A. | ①中溶液变黄,③中溶液橙色加深 | |
| B. | 上述可逆反应的平衡常数:①<③ | |
| C. | K2Cr2O7溶液的氧化性在酸性条件下更强 | |
| D. | 若向④中加入70%H2SO4溶液至过量,溶液变为橙色 |
| A. | 使用蒸馏水 | B. | 使用NaHCO3溶液 | ||
| C. | 使用CuSO4和NaOH溶液 | D. | 使用pH试纸 |
Ⅰ.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:CO(g)+H2O(g)?CO2(g)+H2(g)
(1)向1L恒容密闭容器中充人CO和H2O(g),800℃时测得部分数据如下表.
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
(2)相同条件下,向2L恒容密闭容器中充入1molCO、1mol H2O(g)、2molCO2、2mo1H2,
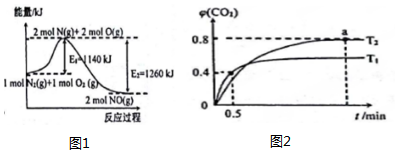
此时υ(正)< υ(逆)(填“>”“=”或“<”).
(3)一定温度下,在恒容密闭容器中NO2与O2反应如下:4NO2(g)+O2(g)?2N2O5(g);若已知K350℃<K300℃,则该反应是放热反应(填“吸热”或“放热”).
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1
(4)利用CO、H2合成液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=-129kJ•mol-1.
(5)依据化学反应原理,分析增加压强对制备甲醇反应的影响增加压强使反应速率加快,同时平衡右移,CH3OH产率增大.
Ⅲ.为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:

一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O${\;}_{2}^{-}$
(6)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式C8H18-50e-+25O2-=8CO2+9H2O.
(7)已知一个电子的电量是1.602×10-19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH80g.
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一.
(8)将CO2转化成有机物可有效地实现碳循环.如:
a.6CO2+6H2O$\stackrel{光照/叶绿素}{→}$C6H12O6+6O2
b.2CO2+6H2$→_{△}^{催化剂}$C2H5OH+3H2O
c.CO2+CH4$→_{△}^{催化剂}$ CH3COOH
d.2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2O
以上反应中,最节能的是,反应c中理论上原子利用率为100%.
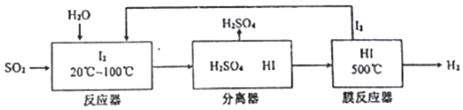
 .
.