题目内容
3. 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用图1装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用图1装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.(1)写出该反应的化学方程式3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe 3O4+4H2,
(2)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是一定有Fe3O4,可能有Fe,若溶液未变红色则说明硬质试管中固体物质的成分是Fe3O4和Fe.
(3)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是Fe+2Fe3+=3Fe2+(用离子方程式表示).
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应.若按图2所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式FeSO4+2NaOH=Fe(OH)2↓+Na2SO4;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(5)一段时间后,该同学发现(4)中未变红的溶液变成红色,说明Fe2+具有还原 性.由此可知,实验室中含Fe2+的盐溶液现用现配制的原因是Fe2+易被空气中的氧气氧化而变质,并且配制含Fe2+的盐溶液时应加入少量铁粉.
分析 (1)铁与水蒸气发生氧化还原反应,生成四氧化三铁和氢气,据此书写化学方程式;
(2)KSCN溶液溶液变红色,说明有三价铁离子;溶液未变红色,说明无三价铁离子;
(3)铁单质能将三价铁离子还原成二价铁离子;
(4)滴入NaOH溶液时,生成的白色沉淀迅速变成灰绿色,最后变成红褐色;
(5)铁单质能将三价铁离子还原成二价铁离子,Fe2+具有还原性,Fe2+易被空气中的氧气氧化而变质,铁粉能与三价铁离子反应生成二价铁离子.
解答 解:(1)铁与水蒸气发生氧化还原反应,生成四氧化三铁和氢气,方程式:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe 3O4+4H2;
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe 3O4+4H2;
(2)KSCN溶液溶液变红色,说明有三价铁离子,说明硬质试管中固体一定有Fe3O4,可能有Fe;KSCN溶液未变红色,说明无三价铁离子,一定有Fe3O4和Fe,
故答案为:一定有Fe3O4,可能有Fe;Fe3O4和Fe;
(3)铁单质能将三价铁离子还原成三价铁离子离子方程式,Fe+2Fe3+=3Fe2+,
故答案为:Fe+2Fe3+=3Fe2+;
(4)滴入NaOH溶液时,生成的白色沉淀迅速变成灰绿色,最后变成红褐色,该反应为FeSO4+2NaOH=Fe(OH)2↓+Na2SO4;4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(5)铁单质能将三价铁离子还原成二价铁离子,Fe2+具有还原性,Fe2+易被空气中的氧气氧化而变质,铁粉能与三价铁离子反应生成二价铁离子,所以配制含Fe2+的盐溶液时应加入少量 铁粉;
故答案为:还原;Fe2+ 易被空气中的氧气氧化而变质;铁粉.
点评 本题以铁与水的反应考查氧化还原反应,明确物质的性质及反应中元素的化合价变化,掌握铁和水蒸气反应的原理和产物的检验是解答的关键,注意不同价态铁元素之间的转化.

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案| A. | 使用蒸馏水 | B. | 使用NaHCO3溶液 | ||
| C. | 使用CuSO4和NaOH溶液 | D. | 使用pH试纸 |
| A. | 当a=0.1时,发生的反应为2I-+Br2═I2+2Br- | |
| B. | 当a=0.25时,发生的反应为2Fe2++4I-+3Br2═2Fe3++2I2+6Br- | |
| C. | 当溶液中I-有一半被氧化是,c(I-):c(Br-)═1:1 | |
| D. | 当a=0.28时,4Fe2++10I-+7Br2═4Fe3++5I2+14Br- |
①将
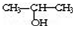 与NaOH的醇溶液共热制备CH3-CH═CH2
与NaOH的醇溶液共热制备CH3-CH═CH2②
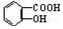 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备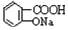
③用浓溴水除去苯中混有的苯酚
④用溴水即可检验CH2=CH-CHO中的碳碳双键.
| A. | 只有③④ | B. | 只有①④ | C. | 只有① | D. | 都不能 |
| A. | 实验室应将钠保存在煤油中 | |
| B. | 分液漏斗和容量瓶在使用前都要检漏 | |
| C. | 可用酒精代替CCl4萃取碘水中的碘单质 | |
| D. | 金属镁失火不可用水来灭火 |
 NaHNa+[:H]- CsOH
NaHNa+[:H]- CsOH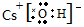 HSCN
HSCN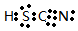 O22-
O22- .
. .
.