题目内容
6.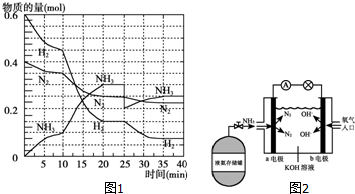 氨在工农业生产中应用广泛.德国人哈伯发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图1所示:
氨在工农业生产中应用广泛.德国人哈伯发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图1所示:(1)10min内用NH3表示该反应的平均速率,v(NH3)=0.005mol/(L•min).
(2)在10~20min内NH3浓度变化的原因可能是a(填字母).
a.加了催化剂 b.降低温度 c.增加NH3的物质的量
(3)该可逆反应达到平衡的标志是ce (填字母).
a.3v(H2)正=2v(NH3)逆
b.混合气体的密度不再随时间变化
c.容器内的总压强不再随时间而变化
d.N2、H2、NH3的分子数之比为1:3:2
e.单位时间生成m mol N2的同时消耗3m mol H2
f.a mol N≡N键断裂的同时,有6a mol N-H键合成
(4)第一次平衡时,平衡常数K1=K1=$\frac{(0.15)^{2}}{(0.125)×(0.075)^{3}}$(用数学表达式表示).NH3的体积分数是42.86%(保留2位小数).
(5)在反应进行到25min时,曲线发生变化的原因是移走了生成的NH3(或减小了氨气的浓度).
(6)已知:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
氨气完全燃烧生成气态水的热化学方程式是4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266kJ/mol.
(7)氨氧燃料电池具有很大的发展潜力.氨氧燃料电池工作原理如图2所示:
①a电极的电极反应式是2NH3-6e-+6OH-═N2+6H2O;
②一段时间后,需向装置中补充KOH,请依据反应原理解释原因是由于电池反应生成水,4NH3+3O2=2N2+6H2O,所以电解质中氢氧根浓度减小,即碱性减弱,pH减小,为维持碱溶液的浓度不变需要向装置中补充KOH.
分析 (1)10min内氨气的物质的量不会为0.10mol,根据反应速率v=$\frac{\frac{△n}{V}}{△t}$计算;
(2)根据图象知,平衡向正反应方向移动,10min时是连续的,三种气体物质的速率增加倍数相同,说明为使用催化剂;
(3)可逆反应达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断;
(4)化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;相同条件下气体体积分数等于其物质的量分数;
(5)25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,据此判断改变的条件;
(6)已知:①N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol
②2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
根据盖斯定律②×3-①×2可得4NH3(g)+3O2(g)═2N2(g)+6H2O(g),据此计算出其焓变即可;
(7)①燃料电池中,负极上是燃料氨发生失电子的氧化反应;
②根据电极反应式分析氢氧根离子浓度的变化情况.
解答 解:(1)根据图象可知,10min时氨气的物质的量为0.1mol,则10min内用NH3表示该反应的平均速率为:v(NH3)=$\frac{\frac{0.10mol}{2L}}{10min}$=0.005 mol/(L•min),
故答案为:0.005 mol/(L•min);
(2)由图象可知各组分物质的量变化增加,且10min时变化是连续的,20min达平衡时,△n(N2)=0.025mol×4=0.1mol,△n(H2)=0.025mol×12=0.3mol,△n(NH3)=0.025mol×8=0.2mol,物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10min可能改变的条件是使用催化剂;而降低温度,应该反应速率减小,增加NH3物质的量,逆反应速率增加的倍数大,故只有使用催化剂符合,故a正确,
故答案为:a;
(3)a.3v(H2)正=2v(NH3)逆,表示的是正反应和逆反应,但是不满足计量数关系,说明没有达到平衡状态,故a错误;
b.混合气体的质量不变,气体的体积不变,故密度不变,若密度不再随时间变化,不能说明平衡,故b错误;
c.容器内前后气体的物质的量有变化,说明压强时变量,总压强不再随时间而变化,说明平衡,故c正确;
d.N2、H2、NH3的分子数之比为1:3:2,无法判断各组分的浓度是否不再变化,故d错误;
e.单位时间生成m mol N2的同时消耗3m mol H2,方向相反成正比例,故e正确;
f.a mol N≡N键断裂的同时,有6a mol N-H键合成,表示的都是正反应,无法判断是否达到平衡状态,故f错误;
故答案为:c e;
(4)由图象可知,20min时该反应第一次达到平衡状态,n(N2)=0.025mol×10=0.25mol,则c(N2)=$\frac{0.25mol}{2L}$=0.125mol/L,n(H2)=0.025mol×6=0.15mol,则c(H2)=$\frac{0.15mol}{2L}$=0.075mol/L,n(NH3)=0.025mol×12=0.3mol,则c(NH3)=$\frac{0.3mol}{2L}$=0.15mol/L,所以第一次平衡时,平衡常数K1=$\frac{(0.15)^{2}}{(0.125)×(0.075)^{3}}$;此时氨气的体积分数=物质的量分数=$\frac{0.3mol}{0.25mol+0.15mol+0.3mol}$×100%≈42.86%,
故答案为:K1=$\frac{(0.15)^{2}}{(0.125)×(0.075)^{3}}$;42.86%;
(5)根据图象可知第25分钟时NH3的物质的量突然减少,H2、N2的物质的量不变,说明改变条件应是移走了生成的NH3,
故答案为:移走了生成的NH3(或减小了氨气的浓度);
(6)已知:①N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol、②2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,
根据盖斯定律②×3-①×2得:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=(-483.6kJ/mol)×3-(-92.4kJ/mol)×2=-1266kJ/mol,
即氨气完全燃烧生成气态水的热化学方程式是:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266kJ/mol,
故答案为:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266kJ/mol;
(7)①燃料电池中,负极上是燃料氨发生失电子的氧化反应,a电极通入的是氨气,为负极,负极上燃料氨气失电子发生氧化反应,电极反应式为:2NH3-6e-+6OH-═N2+6H2O,b电极为正极,电极反应为:O2+2H2O+4e-=4OH-,
故答案为:2NH3-6e-+6OH-═N2+6H2O;
②反应一段时间后,由于电池反应生成水,4NH3+3O2=2N2+6H2O,所以电解质中氢氧根浓度减小,即碱性减弱,pH减小,为维持碱溶液的浓度不变需要向装置中补充KOH,
故答案为:由于电池反应生成水,4NH3+3O2=2N2+6H2O,所以电解质中氢氧根浓度减小,即碱性减弱,pH减小,为维持碱溶液的浓度不变需要向装置中补充KOH.
点评 本题考查较为综合,涉及化学平衡计算、反应热与焓变、原电池工作原理、化学平衡状态的判断等知识,题目浓度较大,明确化学平衡及其影响为解答关键,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用能力.

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
下列说法正确的是( )
| A. | 丙的分子式为C11H11O3 | |
| B. | 甲分子中含有1个手性碳原子 | |
| C. | 乙、丙各lmol分别和氢气反应,最多消耗氢气均为4mol | |
| D. | 丙可发生加成反应、取代反应、氧化反应等 |
| 实验装置 | 实验现象 |
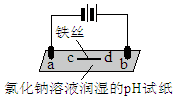 | a处试纸变蓝; b处变红,局部褪色; c处试纸变蓝; d处无明显变化 |
| A. | a为电解池的阴极 | |
| B. | b处有氯气生成,且与水反应生成了盐酸和次氯酸 | |
| C. | d处发生了反应:Fe-3e-=Fe3+ | |
| D. | c处:2H2O+2e-=H2↑+2OH- |
| A. | 使用蒸馏水 | B. | 使用NaHCO3溶液 | ||
| C. | 使用CuSO4和NaOH溶液 | D. | 使用pH试纸 |
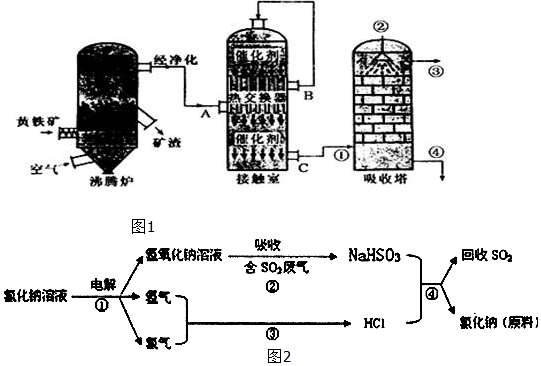
(1)用黄铁矿为原料生产SO2,反应的化学方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉进行(填设备名称).
(2)为提高SO3吸收率,实际生产中用98.3%浓硫酸吸收SO3;这样做的优点是防止吸收过程中产生酸雾,提高SO3吸收率和硫酸的产率.
(3)由A排出的炉渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3化合而成),其中硫酸铜的质量分数随温度不同而变化(见下表):
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如图2:试写出②、④的化学反应方程式NaOH+SO2═NaHSO3、NaHSO3+HCl═NaCl+H2O+SO2↑.
| A. | 当a=0.1时,发生的反应为2I-+Br2═I2+2Br- | |
| B. | 当a=0.25时,发生的反应为2Fe2++4I-+3Br2═2Fe3++2I2+6Br- | |
| C. | 当溶液中I-有一半被氧化是,c(I-):c(Br-)═1:1 | |
| D. | 当a=0.28时,4Fe2++10I-+7Br2═4Fe3++5I2+14Br- |
①将
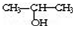 与NaOH的醇溶液共热制备CH3-CH═CH2
与NaOH的醇溶液共热制备CH3-CH═CH2②
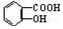 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备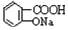
③用浓溴水除去苯中混有的苯酚
④用溴水即可检验CH2=CH-CHO中的碳碳双键.
| A. | 只有③④ | B. | 只有①④ | C. | 只有① | D. | 都不能 |
| 原子组成 | Z | N | A |
| 3919K | 19 | 20 | 39 |
| 168O | 8 | 8 | 16 |
| 4018Ar | 18 | 22 | 40 |
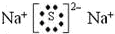 .
.