��Ŀ����
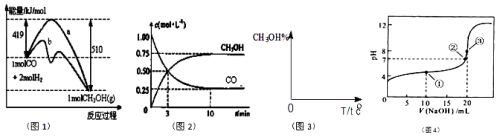
12������˵����ȷ���ǣ�������| A�� | ij���ȷ�Ӧ���Է����У���˸÷�Ӧ��������Ӧ | |
| B�� | �ö��Ե缫��⺬�� H218O����ͨˮʱ���������ܲ���������Է���������ͬ�������� | |
| C�� | ��Ӧ A��g��?B��g����H��������Ӧ�Ļ��Ϊ EakJ/mol���淴Ӧ�Ļ��Ϊ EbkJ/mol�����H=-��Ea-Eb��kJ/mol | |
| D�� | 3x%�� A ���ʵ���Һ�� x%�� A ���ʵ���Һ�������Ϻ���Һ��������С�� 2x%���� A �� ��Ϊ�Ҵ� |
���� A��G��0�ķ�Ӧ���Է����У�
B���ö��Ե缫��⺬�� H218O����ͨˮʱ��������OH-��18OH-ͬʱ�ŵ磻
C����Ӧ���ʱ�������淴Ӧ���֮�
D����ij��Һ�Ħѣ�1g/mLʱ���������Ϻ����������С��ƽ��ֵ��
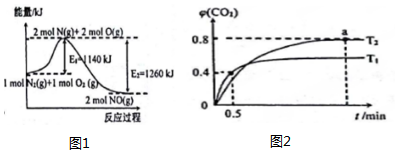
��� �⣺A��G=��H-T•��S��0�ķ�Ӧ���Է����У����ڷ�Ӧʱ���ȷ�Ӧ���ʵ��ڵ���ʱ����ʹ���ؼ��ķ�ӦҲ���Է����У���A����
B���ö��Ե缫��⺬�� H218O����ͨˮʱ��������OH-��18OH-ͬʱ�ŵ磬�����ɵ�������16O2��18O2��16O18O��������������Է���������ͬ���������ӣ���B����
C���淴Ӧ�Ļ��=����Ӧ�Ļ��+��Ӧ���ʱ䣬���ԡ�H=�淴Ӧ�Ļ��-����Ӧ�Ļ��=��Ea-Eb��kJ•mol-1����C����
D����ij��Һ�Ħѣ�1g/mLʱ���������Ϻ����������С��ƽ��ֵ�����Ҵ���Һ���ܶ�С��ˮ���ʽ�3x%��A���ʵ���Һ��x%��A���ʵ���Һ�������Ϻ���Һ����������С��2x%����D��ȷ��
��ѡD��
���� �����ۺϿ����˷�Ӧ�ܷ�˹�����ܡ����ԭ����Ӧ�õȣ��ۺ��Խ�ǿ���Ѷ����У�Ӧע���ǿ����֪ʶ�����գ�

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
2�����̿���Ҫ�ɷ���MnO2�������KOH��KClO3�����ڸ����·�Ӧ������K2MnO4��KCl���䷴Ӧ��ѧ����ʽΪ MnO2+KOH+KClO3$\frac{\underline{\;\;��\;\;}}{\;}$K2MnO4+KCl+H2O��δ��ƽ������˵������ȷ���ǣ�������
| A�� | ��Ӧ��MnO2�������� | |
| B�� | ���������뻹ԭ�������ʵ���֮��Ϊ1��3 | |
| C�� | KClO3�ڷ�Ӧ��ʧȥ���� | |
| D�� | ��Ӧ��ÿ����l mol K2MnO4���������õ�2 mol���� |
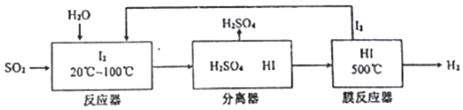
20����֪K2Cr2O7��Һ�д���ƽ�⣺Cr2O72- ����ɫ��+H2O?2CrOr42- ����ɫ��+2H+�����¶Ȳ��䣬��k2O2O7��Һ��������ʵ�飺���ʵ�飬����˵����ȷ���ǣ�������
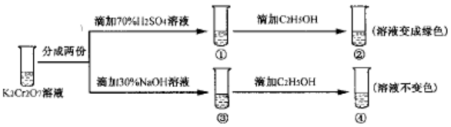

| A�� | ������Һ��ƣ�������Һ��ɫ���� | |
| B�� | �������淴Ӧ��ƽ�ⳣ�����٣��� | |
| C�� | K2Cr2O7��Һ�������������������¸�ǿ | |
| D�� | ������м���70%H2SO4��Һ����������Һ��Ϊ��ɫ |
7����ʯī�缫������е��ʵ�飮���ж�ʵ������Ľ��ͻ��Ʋⲻ�������ǣ�������
| ʵ��װ�� | ʵ������ |
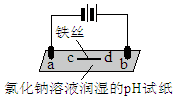 | a����ֽ������ b����죬�ֲ���ɫ�� c����ֽ������ d�������Ա仯 |
| A�� | aΪ���ص����� | |
| B�� | b�����������ɣ�����ˮ��Ӧ����������ʹ����� | |
| C�� | d�������˷�Ӧ��Fe-3e-=Fe3+ | |
| D�� | c����2H2O+2e-=H2��+2OH- |
4���������ȩ�ļ����ж��ַ��������п��еIJ����������һ���ǣ�������
| A�� | ʹ������ˮ | B�� | ʹ��NaHCO3��Һ | ||
| C�� | ʹ��CuSO4��NaOH��Һ | D�� | ʹ��pH��ֽ |
 NaHNa+[��H]- CsOH
NaHNa+[��H]- CsOH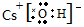 HSCN
HSCN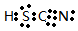 O22-
O22- ��
��
 ��
��