题目内容
(1)科学家一直致力研究常温、常压下“人工固氮“的新方法.曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,
2N2(g)+6H2O(1)?4NH3(g)+3O2(g)△H=akj.mol-1,
已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kj.mol-1,
2H2(g)+O2(g)═2H2O(1)△H=-571.6kj.mol-1,
则2N2(g)+6H2O(1)?4NH3(g)+3O2(g)△H= ;
(2)白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:
P-P akJ?mol-1、P-O bkJ?mol-1、P=O ckJ?mol-1、O=O dkJ?mol-1.
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是 .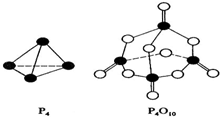
A.(6a+5d-4c-12b)kJ?mol-1
B.(4c+12b-6a-5d)kJ?mol-1
C.(4c+12b-4a-5d)kJ?mol-1
D.(4a+5d-4c-12b)kJ?mol-1
(3)0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出 649.5kJ的热量,则该反应的热化学方程式 ,又已知H2O(l)转化为H2O(g)的△H=+44kJ?mol-1,则11.2L(标准状况)气态乙硼烷完全燃烧生成气态水时放出的热量是 .
(4)反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)
下列示意图中,能正确表示总反应过程中能量变化的是 .

2N2(g)+6H2O(1)?4NH3(g)+3O2(g)△H=akj.mol-1,
已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kj.mol-1,
2H2(g)+O2(g)═2H2O(1)△H=-571.6kj.mol-1,
则2N2(g)+6H2O(1)?4NH3(g)+3O2(g)△H=
(2)白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:
P-P akJ?mol-1、P-O bkJ?mol-1、P=O ckJ?mol-1、O=O dkJ?mol-1.
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是

A.(6a+5d-4c-12b)kJ?mol-1
B.(4c+12b-6a-5d)kJ?mol-1
C.(4c+12b-4a-5d)kJ?mol-1
D.(4a+5d-4c-12b)kJ?mol-1
(3)0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出 649.5kJ的热量,则该反应的热化学方程式
(4)反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)
下列示意图中,能正确表示总反应过程中能量变化的是

考点:用盖斯定律进行有关反应热的计算,有关反应热的计算
专题:化学反应中的能量变化
分析:(1)利用盖斯定律计算;
(2)反应热△H=反应物总键能-生成物总键能,据此计算判断.注意每摩尔P4中含有6molP-P键;
(3)0.3mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出2165KJ的热量,根据盖斯定律写出其热化学反应方程式,后根据物质的物质的量与反应放出的热量成正比来解答;
(4)根据物质具有的能量进行计算:△H=E(生成物的总能量)-E(反应物的总能量),当反应物的总能量大于生成物的总能量时,反应放热,当反应物的总能量小于生成物的总能量时,反应吸热,以此解答该题.
(2)反应热△H=反应物总键能-生成物总键能,据此计算判断.注意每摩尔P4中含有6molP-P键;
(3)0.3mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出2165KJ的热量,根据盖斯定律写出其热化学反应方程式,后根据物质的物质的量与反应放出的热量成正比来解答;
(4)根据物质具有的能量进行计算:△H=E(生成物的总能量)-E(反应物的总能量),当反应物的总能量大于生成物的总能量时,反应放热,当反应物的总能量小于生成物的总能量时,反应吸热,以此解答该题.
解答:
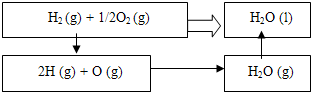
解:(1)已知:①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1
则利用盖斯定律,将①×2-②×3可得常温下氮气与水反应生成氨气与氧气的热化学方程式为2N2(g)+6H2O(l)=4NH3(g)+3O2(g)
△H=2×(-92.4kJ?mol-1)-3×(-571.6kJ?mol-1)=+1536kJ?mol-1,
故答案为:+1536kJ?mol-1;
(2)各化学键键能为P-P a kJ?mol-1、P-O b kJ?mol-1、P=O c kJ?mol-1、O=O d kJ?mol-1.
反应热△H=反应物总键能-生成物总键能,
所以反应P4+5O2=P4O10的反应热△H=6akJ?mol-1+5dkJ?mol-1-(4ckJ?mol-1+12bkJ?mol-1)=(6a+5d-4c-12b)kJ?mol-1,
故选:A;
(3)0.3mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出2165KJ的热量,反应的热化学方程式为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol,
①B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol,
②H2O(l)=H2O(g);△H=+44kJ/moL,
由盖斯定律可知①+②×3得:B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2033kJ/mol,
11.2L(标准状况)即0.5mol乙硼烷完全燃烧生成气态水时放出的热量是2033kJ×0.5=1016.5kJ,
故答案为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol;1016.5;
(4)由反应 A+B→C(△H>0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0),可以看出,A+B→C(△H>0)是吸热反应,A和B的能量之和小于C,
由①A+B→X (△H>0)可知这步反应是吸热反应,故X的能量大于A+B,X→C(△H<0)是放热反应,X 的能量大于C;图象B符合;
故选B.
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1
则利用盖斯定律,将①×2-②×3可得常温下氮气与水反应生成氨气与氧气的热化学方程式为2N2(g)+6H2O(l)=4NH3(g)+3O2(g)
△H=2×(-92.4kJ?mol-1)-3×(-571.6kJ?mol-1)=+1536kJ?mol-1,
故答案为:+1536kJ?mol-1;
(2)各化学键键能为P-P a kJ?mol-1、P-O b kJ?mol-1、P=O c kJ?mol-1、O=O d kJ?mol-1.
反应热△H=反应物总键能-生成物总键能,
所以反应P4+5O2=P4O10的反应热△H=6akJ?mol-1+5dkJ?mol-1-(4ckJ?mol-1+12bkJ?mol-1)=(6a+5d-4c-12b)kJ?mol-1,
故选:A;
(3)0.3mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出2165KJ的热量,反应的热化学方程式为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol,
①B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol,
②H2O(l)=H2O(g);△H=+44kJ/moL,
由盖斯定律可知①+②×3得:B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2033kJ/mol,
11.2L(标准状况)即0.5mol乙硼烷完全燃烧生成气态水时放出的热量是2033kJ×0.5=1016.5kJ,
故答案为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol;1016.5;
(4)由反应 A+B→C(△H>0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0),可以看出,A+B→C(△H>0)是吸热反应,A和B的能量之和小于C,
由①A+B→X (△H>0)可知这步反应是吸热反应,故X的能量大于A+B,X→C(△H<0)是放热反应,X 的能量大于C;图象B符合;
故选B.
点评:考查盖斯定律的应用,反应热与化学键键能的关系,热化学方程式的书写,物质具有的能量和反应热的关系等,难度中等,注意从物质能量、键能理解反应热.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
常温时,等体积等物质的量浓度的下列物质的溶液中,水的电离程度由大到小顺序排列正确的是( )
①Na2CO3 ②NaHSO4 ③CH3COOH ④NaHCO3.
①Na2CO3 ②NaHSO4 ③CH3COOH ④NaHCO3.
| A、①>②>③>④ |
| B、①>④>③>② |
| C、②>①>③>④ |
| D、②>③>④>① |
关于CaCO3沉淀的溶解平衡说法正确的是( )
| A、CaCO3沉淀生成和沉淀溶解不断进行,但速率相等 |
| B、CaCO3难溶于水,溶液中没有Ca2+和CO32- |
| C、升高温度,CaCO3沉淀的溶解度无影响 |
| D、向CaCO3沉淀中加入Na2CO3固体,CaCO3沉淀的溶解度不变 |
下列叙述正确的是( )
| A、25℃时,MgCO3饱和溶液中c(Mg2+)=2.6×10-3mol?L-1,CaCO3饱和溶液中c(Ca2+)=5.3×10-5mol?L-1,向浓度均为0.1 mol?L-1的MgCl2和CaCl2混合溶液中逐滴加入0.1 mol?L-1的Na2CO3溶液,首先生成 CaCO3沉淀 |
| B、0.1 mol/LNa2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
| C、pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 |
| D、已知Fe3++2 I-=Fe2++I2,则浓度和体积相同的FeBr2、FeI2溶液中,分别通入少量氯气后都首先发生置换反应 |
在下列假设引导下的探究肯定没有意义的是( )
| A、探究Na在空气中放置后的生成物是Na2CO3 |
| B、探究Na与水反应有O2生成 |
| C、探究含铁元素的营养酱油中的铁以Fe2+或Fe3+的形式存在 |
| D、探究向滴有酚酞的NaOH溶液中通Cl2时,溶液褪色是NaClO的漂白性所致 |