题目内容
甲醇是一种很好的燃料,工业上可用多种原料通过不同的反应制得甲醇.
(1)已知在常温常压下:
CH3OH(l)+O2(g)=CO(g)+2H20(l)△H=-442.8kJ?mol-1
2CO(g)+O2(g)=2CO2(g)△H=-556.0kJ?mol-1
H2O(g)=H2O(l)△H=-44.0kJ?mol-1
则2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H= kJ?mol-1
(2)工业上正在研究利用来生产甲醇燃料的方法,该反应为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1
在某温度下,将6mol CO2和8mol H2充入容积为2L的密闭容器中,8分钟时达平衡状态,H2的转化率为75%.请回答:
①用CH3OH表示该反应在0-8min内的平均反应速率v(CH3OH)= .
②此温度下该反应平衡常数K= L2?mol-2;
③若在上述平衡体系中,再充入2mol H2,反应达到平衡后的转化率 75%(填“大于”、“小于”或“等于”).
(3)一氧化碳与氢气也可以合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H<0
①若该反应在恒温恒容条件下进行,下列说法正确的是 ;
a.若混合气体的密度不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入CH3OH(g)使压强增大,平衡向右移动
c.反应达到平衡后,通入氩气使压强增大,平衡向右移动
d.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
e.若使用催化剂,会改变反应的途径,但反应的不变
②某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数K=50L2?mol-2,反应到某时刻测得各组分的物质的量如下:
请比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”).
(1)已知在常温常压下:
CH3OH(l)+O2(g)=CO(g)+2H20(l)△H=-442.8kJ?mol-1
2CO(g)+O2(g)=2CO2(g)△H=-556.0kJ?mol-1
H2O(g)=H2O(l)△H=-44.0kJ?mol-1
则2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=
(2)工业上正在研究利用来生产甲醇燃料的方法,该反应为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1
在某温度下,将6mol CO2和8mol H2充入容积为2L的密闭容器中,8分钟时达平衡状态,H2的转化率为75%.请回答:
①用CH3OH表示该反应在0-8min内的平均反应速率v(CH3OH)=
②此温度下该反应平衡常数K=
③若在上述平衡体系中,再充入2mol H2,反应达到平衡后的转化率
(3)一氧化碳与氢气也可以合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H<0
①若该反应在恒温恒容条件下进行,下列说法正确的是
a.若混合气体的密度不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入CH3OH(g)使压强增大,平衡向右移动
c.反应达到平衡后,通入氩气使压强增大,平衡向右移动
d.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
e.若使用催化剂,会改变反应的途径,但反应的不变
②某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数K=50L2?mol-2,反应到某时刻测得各组分的物质的量如下:
| 物质 | CO | H2 | CH3OH |
| 物质的量/(mol) | 0.4 | 0.4 | 0.8 |
考点:用盖斯定律进行有关反应热的计算,化学平衡的影响因素,化学平衡状态的判断
专题:基本概念与基本理论
分析:(1)根据盖斯定律解答;
(2)①根据v=
计算;
②根据三段式计算平衡时各组分的浓度,计算平衡常数;
③平衡以后通入氢气,二氧化碳的转化率增大,氢气的转化率减小;
(3)①a.恒温恒容条件下,质量守恒,密度ρ=
是一个常量,不能说明反应已达化学平衡状态,故错误;
b.由于是恒温恒容,通入CH3OH(g)使压强不变,平衡不移动;
c.反应达到平衡后,通入氩气压强不变,平衡向左移动;
d.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小;
e.平衡常数是只与温度有关的物理量.若使用催化剂,会改变反应的途径,但反应的平衡常数不变;
②计算出此时的此时
与平衡常数比较,根据平衡的移动方向判断正逆反应速率的大小.
(2)①根据v=
| △c |
| △t |
②根据三段式计算平衡时各组分的浓度,计算平衡常数;
③平衡以后通入氢气,二氧化碳的转化率增大,氢气的转化率减小;
(3)①a.恒温恒容条件下,质量守恒,密度ρ=
| m |
| V |
b.由于是恒温恒容,通入CH3OH(g)使压强不变,平衡不移动;
c.反应达到平衡后,通入氩气压强不变,平衡向左移动;
d.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小;
e.平衡常数是只与温度有关的物理量.若使用催化剂,会改变反应的途径,但反应的平衡常数不变;
②计算出此时的此时
| c(CH3OH) |
| c(CO)c2(H2) |
解答:
解:(1)CH3OH(l)+O2(g)=CO(g)+2H20(l)△H=-442.8kJ?mol-1 ①
2CO(g)+O2(g)=2CO2(g)△H=-556.0kJ?mol-1 ②
H2O(g)=H2O(l)△H=-44.0kJ?mol-1 ③
由热化学方程式①×2+②-③×4,根据盖斯定律反应热△H也做相应的变化,得2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ?mol-1,
故答案为:-1275.6;
(2)①反应的氢气的物质的量为8mol×75%=6mol,根据CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1,知生成的CH3OH为2mol,根据v=
=
=0.125mol?L-1?min-1,故答案为:0.125 mol?L-1?min-1;
②由化学平衡CO2+3H2?CH3OH+H2O
起始量 6mol 8mol 0 0
变化量 2mol 6mol 2mol 2mol
平衡量 4mpl 2mol 2mol 2mol
CO2、3H2、CH3OH、H2O的物质的量浓度分别为2mol/L、1mol/L、1mol/L、1mol/L,
平衡常数K=
=
=0.5,故答案为:0.5;
③平衡以后通入氢气,二氧化碳的转化率增大,氢气的转化率减小,故答案为:小于;
(3)①a.恒温恒容条件下,质量守恒,密度ρ=
是一个常量,不能说明反应已达化学平衡状态,故错误;
b.由于是恒温恒容,通入CH3OH(g)使压强不变,平衡不移动,故错误;
c.反应达到平衡后,通入氩气压强不变,平衡向左移动,故错误;
d.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小,故正确;
e.平衡常数是只与温度有关的物理量.若使用催化剂,会改变反应的途径,但反应的平衡常数不变,故正确;
故答案为:de;
②此时
=
=K=50L2?mol-2,所以反应处于平衡状态,正、逆反应速率相等,故答案为:=.
2CO(g)+O2(g)=2CO2(g)△H=-556.0kJ?mol-1 ②
H2O(g)=H2O(l)△H=-44.0kJ?mol-1 ③
由热化学方程式①×2+②-③×4,根据盖斯定律反应热△H也做相应的变化,得2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ?mol-1,
故答案为:-1275.6;
(2)①反应的氢气的物质的量为8mol×75%=6mol,根据CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1,知生成的CH3OH为2mol,根据v=
| △c |
| △t |
| ||
| 8min |
②由化学平衡CO2+3H2?CH3OH+H2O
起始量 6mol 8mol 0 0
变化量 2mol 6mol 2mol 2mol
平衡量 4mpl 2mol 2mol 2mol
CO2、3H2、CH3OH、H2O的物质的量浓度分别为2mol/L、1mol/L、1mol/L、1mol/L,
平衡常数K=
| c(CH3OH)c(H2O) |
| c3(H2)c(CO2) |
| 1mol/L×1mol/L |
| (1mol/L)3×2mol/L |
③平衡以后通入氢气,二氧化碳的转化率增大,氢气的转化率减小,故答案为:小于;
(3)①a.恒温恒容条件下,质量守恒,密度ρ=
| m |
| V |
b.由于是恒温恒容,通入CH3OH(g)使压强不变,平衡不移动,故错误;
c.反应达到平衡后,通入氩气压强不变,平衡向左移动,故错误;
d.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小,故正确;
e.平衡常数是只与温度有关的物理量.若使用催化剂,会改变反应的途径,但反应的平衡常数不变,故正确;
故答案为:de;
②此时
| c(CH3OH) |
| c(CO)c2(H2) |
| 0.8 |
| 0.4×0.42 |
点评:本题考查了利用盖斯定律进行有关反应热的计算、化学平衡的影响因素以及平衡平衡状态的判断,难度不大,注意利用三段式进行有关化学平衡的计算.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是( )
| A、盐酸、水煤气、醋酸、干冰 |
| B、硝酸、酒精、苛性钠、氨气 |
| C、冰醋酸、福尔马林、硫酸钠、乙醇 |
| D、胆矾、漂白粉、氯化钾、氯气 |
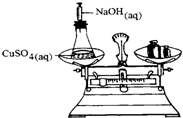 将一密闭的化学反应装置在天平上称量(如图所示).当在溶液中注入氢氧化钠溶液之后,下列叙述正确的是( )
将一密闭的化学反应装置在天平上称量(如图所示).当在溶液中注入氢氧化钠溶液之后,下列叙述正确的是( )| A、会有沉淀产生,天平左盘质量增加 |
| B、有气体产生,天平左盘质量减少 |
| C、此实验可用于说明化学反应的质量守恒 |
| D、本反应的离子方程式为:CuSO4+2OH-═Cu(OH)2↓+SO42- |
已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,(MgF2的溶度积常数Ksp=7.4×10-11)取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
| A、所得溶液中的c(H+)=1.0×10-13mol?L-1 |
| B、所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol?L-1 |
| C、所得溶液中的c(Mg2+)=5.6×10-10 mol?L-1 |
| D、298K时,饱和Mg(OH)2的溶液与饱和MgF2溶液相比前者的c(Mg2+)大 |
类比推断法是研究物质性质的常用方法之一,可预测许多物质的性质.但类比推断法是相对的,不能违背客观实际.下列说法正确的是( )
| A、由溶解性CaCO3<Ca(HCO3)2,则溶解性Na2CO3<NaHCO3 |
| B、向Ca(ClO)2溶液中通入少量CO2可得到CaCO3,则向Ca(ClO)2溶液中通入少量SO2可得到CaSO3 |
| C、由O2与Li加热生成Li2O,则O2与Na加热生成Na2O |
| D、有Fe与S加热生成FeS,则Cu与S加热生成Cu2S |
25℃、101kPa 下:
①2Na(s)+1/2O2(g)=Na2O(s)△H1=-414KJ/mol;
②2Na(s)+O2(g)=Na2O2(s)△H2=-511KJ/mol.
下列说法正确的是( )
①2Na(s)+1/2O2(g)=Na2O(s)△H1=-414KJ/mol;
②2Na(s)+O2(g)=Na2O2(s)△H2=-511KJ/mol.
下列说法正确的是( )
| A、25℃、101kPa 下,Na2O2(s)+2 Na(s)=2Na2O(s)△H=-317kJ/mol |
| B、①和②生成等物质的量的产物,转移电子数不同 |
| C、常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D、①和②产物的阴阳离子个数比不相等 |
下列反应中硫酸既表现氧化性,又表现酸性的有( )
A、2H2SO4(浓)+Cu
| ||||
B、2H2SO4 (浓)+C
| ||||
C、H2SO4 (浓)+NaCl
| ||||
| D、H2SO4+Na2SO3═Na2SO4+H2O+SO2↑ |
CO(g)+NO2(g)?CO2(g)+NO(g)△H<0,若其他条件不变,只改变下列条件,能使混合气体颜色变深的是( )
| A、降低温度 |
| B、增大压强 |
| C、增大CO的浓度 |
| D、使用催化剂 |