题目内容
常温时,等体积等物质的量浓度的下列物质的溶液中,水的电离程度由大到小顺序排列正确的是( )
①Na2CO3 ②NaHSO4 ③CH3COOH ④NaHCO3.
①Na2CO3 ②NaHSO4 ③CH3COOH ④NaHCO3.
| A、①>②>③>④ |
| B、①>④>③>② |
| C、②>①>③>④ |
| D、②>③>④>① |
考点:水的电离
专题:电离平衡与溶液的pH专题
分析:酸溶液和碱溶液抑制了水的电离,酸溶液中的氢离子、碱溶液中的氢氧根离子浓度越大,水的电离程度越小;能够水解的盐溶液促进了水的电离,水解程度越大,水的电离程度越大,据此进行解答.
解答:
解:①Na2CO3 为强碱弱酸盐,碳酸根离子的水解,促进了水的电离;
②NaHSO4为强酸的酸式盐,在溶液中完全电离,溶液显强酸性,电离出来的氢离子抑制水的电离;
③CH3COOH 为弱酸性溶液,电离出来的氢离子抑制水的电离,醋酸部分电离,电离出来的氢离子浓度比②小,对水的抑制程度比②小;
④NaHCO3为强碱弱酸盐,碳酸氢根离子的水解,促进了水的电离,NaHCO3的水解程度比Na2CO3小,则碳酸氢钠溶液中水的电离程度小于①;
所以四种溶液中水的电离程度由大到小排列为:①>④>③>②,
故选B.
②NaHSO4为强酸的酸式盐,在溶液中完全电离,溶液显强酸性,电离出来的氢离子抑制水的电离;
③CH3COOH 为弱酸性溶液,电离出来的氢离子抑制水的电离,醋酸部分电离,电离出来的氢离子浓度比②小,对水的抑制程度比②小;
④NaHCO3为强碱弱酸盐,碳酸氢根离子的水解,促进了水的电离,NaHCO3的水解程度比Na2CO3小,则碳酸氢钠溶液中水的电离程度小于①;
所以四种溶液中水的电离程度由大到小排列为:①>④>③>②,
故选B.
点评:本题考查了水的电离、盐的水解原理离及其影响因素,题目难度不大,注意掌握盐的水解原理、水的电离及其影响因素,明确酸溶液和碱溶液抑制了水的电离,能够水解的盐溶液促进了水的电离.

练习册系列答案
 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是( )
| A、盐酸、水煤气、醋酸、干冰 |
| B、硝酸、酒精、苛性钠、氨气 |
| C、冰醋酸、福尔马林、硫酸钠、乙醇 |
| D、胆矾、漂白粉、氯化钾、氯气 |
下列物质与其用途相符合的是( )
①ClO2-消毒剂
②NaHCO3-治疗胃酸过多
③明矾-做干燥剂
④硅-做光导纤维
⑤Na2O2-呼吸面具的供氧剂
⑥NaClO-漂白纺织物.
①ClO2-消毒剂
②NaHCO3-治疗胃酸过多
③明矾-做干燥剂
④硅-做光导纤维
⑤Na2O2-呼吸面具的供氧剂
⑥NaClO-漂白纺织物.
| A、②④⑤⑥ | B、①②⑤⑥ |
| C、①②④⑤ | D、全部 |
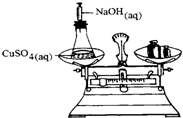 将一密闭的化学反应装置在天平上称量(如图所示).当在溶液中注入氢氧化钠溶液之后,下列叙述正确的是( )
将一密闭的化学反应装置在天平上称量(如图所示).当在溶液中注入氢氧化钠溶液之后,下列叙述正确的是( )| A、会有沉淀产生,天平左盘质量增加 |
| B、有气体产生,天平左盘质量减少 |
| C、此实验可用于说明化学反应的质量守恒 |
| D、本反应的离子方程式为:CuSO4+2OH-═Cu(OH)2↓+SO42- |
已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,(MgF2的溶度积常数Ksp=7.4×10-11)取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
| A、所得溶液中的c(H+)=1.0×10-13mol?L-1 |
| B、所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol?L-1 |
| C、所得溶液中的c(Mg2+)=5.6×10-10 mol?L-1 |
| D、298K时,饱和Mg(OH)2的溶液与饱和MgF2溶液相比前者的c(Mg2+)大 |
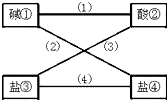 从盐酸、硫酸、石灰水、烧碱、氢氧化钡、纯碱、硝酸钠、氯化钡(均为溶液)八种物质中选出四种,使得各线条相连的物质均能发生反应且生成难溶物.
从盐酸、硫酸、石灰水、烧碱、氢氧化钡、纯碱、硝酸钠、氯化钡(均为溶液)八种物质中选出四种,使得各线条相连的物质均能发生反应且生成难溶物.