题目内容
已知H2(g)+
O2(g)=H2O (l);△H=─285.8KJ/moL可通过两种途径来完成分步进行的热效应如下:
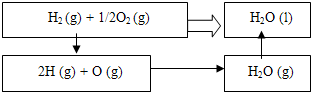
(1)H2(g)=2H△H1=+431.8KJ/moL
(2)
O2(g)=O (g)△H2=+244.3KJ/moL
(3)2H (g)+O (g)=H2O (g)△H3=
(4)H2O (g)→H2O (l)△H=-44kJ/moL.
| 1 |
| 2 |

(1)H2(g)=2H△H1=+431.8KJ/moL
(2)
| 1 |
| 2 |
(3)2H (g)+O (g)=H2O (g)△H3=
(4)H2O (g)→H2O (l)△H=-44kJ/moL.
考点:用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化
分析:依据热化学方程式和盖斯定律计算得到,反应流程中可知,反应H2(g)+
O2(g)=H2O (l)△H=─285.8KJ/moL,焓变等于反应(1)(2)(3)(4)反应焓变之和.
| 1 |
| 2 |
解答:
解:H2(g)+
O2(g)=H2O (l)△H=-285.8KJ/moL,依据盖斯定律,反应焓变和起始物质和终了物质有关于变化过程无关,所以根据盖斯定律
(1)H2(g)=2H△H1=+431.8KJ/moL
(2)
O2(g)=O (g)△H2=+244.3KJ/moL
(3)2H (g)+O (g)=H2O (g)△H3
(4)H2O (g)→H2O (l)△H=-44kJ/moL
(1)+(2)+(3)+(4)=△H=-285.8KJ/moL
则(+431.8KJ/moL)+(+244.3KJ/moL)+△H3+(-44kJ/moL)=-285.8KJ/moL,
解得△H3=-917.9KJ/mol;
故答案为:-917.9KJ/mol.
| 1 |
| 2 |
(1)H2(g)=2H△H1=+431.8KJ/moL
(2)
| 1 |
| 2 |
(3)2H (g)+O (g)=H2O (g)△H3
(4)H2O (g)→H2O (l)△H=-44kJ/moL
(1)+(2)+(3)+(4)=△H=-285.8KJ/moL
则(+431.8KJ/moL)+(+244.3KJ/moL)+△H3+(-44kJ/moL)=-285.8KJ/moL,
解得△H3=-917.9KJ/mol;
故答案为:-917.9KJ/mol.
点评:本题考查了热化学方程式和盖斯定律的计算应用,理解盖斯定律含义是关键,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
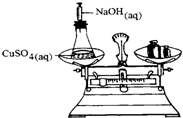 将一密闭的化学反应装置在天平上称量(如图所示).当在溶液中注入氢氧化钠溶液之后,下列叙述正确的是( )
将一密闭的化学反应装置在天平上称量(如图所示).当在溶液中注入氢氧化钠溶液之后,下列叙述正确的是( )| A、会有沉淀产生,天平左盘质量增加 |
| B、有气体产生,天平左盘质量减少 |
| C、此实验可用于说明化学反应的质量守恒 |
| D、本反应的离子方程式为:CuSO4+2OH-═Cu(OH)2↓+SO42- |
下列反应中硫酸既表现氧化性,又表现酸性的有( )
A、2H2SO4(浓)+Cu
| ||||
B、2H2SO4 (浓)+C
| ||||
C、H2SO4 (浓)+NaCl
| ||||
| D、H2SO4+Na2SO3═Na2SO4+H2O+SO2↑ |
 利用下列各组物质制备和收集少量相应气体,能采用如图实验装置的是( )
利用下列各组物质制备和收集少量相应气体,能采用如图实验装置的是( )①浓氨水与固体CaO②稀盐酸与石灰石③稀硝酸与铜片④过氧化氢溶液与MnO2⑤锌粒与稀硫酸⑥浓盐酸与MnO2.
| A、①②⑥ | B、②④ |
| C、①②③⑥ | D、全部 |
下列现象或事实不能用同一原理解释的是( )
| A、浓硝酸和氯水用棕色试剂瓶保存 |
| B、硫化钠和亚硫酸钠固体长期暴露在空气中变质 |
| C、常温下铁和铂都不溶于浓硝酸 |
| D、SO2和Na2SO3溶液都能使氯水褪色 |
CO(g)+NO2(g)?CO2(g)+NO(g)△H<0,若其他条件不变,只改变下列条件,能使混合气体颜色变深的是( )
| A、降低温度 |
| B、增大压强 |
| C、增大CO的浓度 |
| D、使用催化剂 |

 用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )