题目内容
1.现有下列八种物质:①H2 ②铝 ③Na2O ④SO2 ⑤HNO3 ⑥KNO3⑦(NH4)2SO4⑧NaCl溶液(1)按物质的分类方法填写表格的空白处:
| 分类标准 | 金属单质 | 碱性氧化物 | 硝酸盐 | 非电解质 |
| 属于该类的物质(填序号) | ② | ③ | ⑥ | ④ |
分析 (1)②铝为金属单质,和酸反应生成盐和水的氧化物为碱性氧化物,含硝酸跟离子的盐为硝酸盐,非电解质是水溶液中和熔融状态下都不导电的化合物为非电解质;
(2)(NH4)2SO4在水溶液中完全电离生成铵根离子和硫酸根离子.
解答 解:(1)②铝是金属单质,③Na2O 是碱性氧化物,属于硝酸盐的是⑥KNO3 ,非电解质是④SO2,
故答案为:
| 分类标准 | 金属单质 | 碱性氧化物 | 硝酸盐 | 非电解质 |
| 属于该类的物质 | ② | ③ | ⑥ | ④ |
故答案为:(NH4)2SO4═2NH4++SO42-.
点评 本题考查了物质分类、物质组成、物质性质等,注意知识的积累,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
2.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,2.24L丁烷中C-C键数目为0.4NA | |
| B. | 0.1mol葡萄糖分子中官能团数目为0.6NA | |
| C. | 28g N2和NO组成的混合物中分子数目可能为0.9NA | |
| D. | 1L pH=13的NaOH溶液中,Na+数目为0.1NA |
12.酸雨是指( )
| A. | pH<7的雨水 | B. | pH<5.6的雨水 | C. | pH=5.6的雨水 | D. | pH>7的雨水 |
9.15LNO2通过水后(未完全反应)收集到7L气体(同温同压),则被氧化的NO2有( )
| A. | 4L | B. | 6L | C. | 8L | D. | 12L |
16.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 11.2L氧气所含的原子数为NA | |
| B. | 2.3g金属钠变为钠离子得到0.1NA电子 | |
| C. | 0.5mol/LH2SO4中的H+数为NA | |
| D. | 常温常压下32g O2与O3的混合物含有的氧原子数为2NA |
13.向Fe2O3、CuO、Fe、Cu的混和粉未中加入过量的稀硫酸,充分反应后,仍有红色粉未存在,则关于溶液中阳离子的判断正确的是( )
| A. | 只有Fe2+和Cu2+ | B. | 一定有Fe2+、Cu2+,可能有Fe3+ | ||
| C. | 一定有Fe2+,可能有Cu2+ | D. | 只有Fe2+ |
10.下列离子化合物中,阳离子、阴离子半径之比最小的是( )
| A. | NaCl | B. | MgCl2 | C. | KBr | D. | MgBr2 |
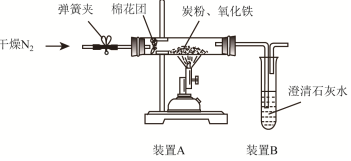

 ,两者气态氢化物的稳定性是:HF>HCl(填写化学式).
,两者气态氢化物的稳定性是:HF>HCl(填写化学式).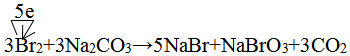 .
.