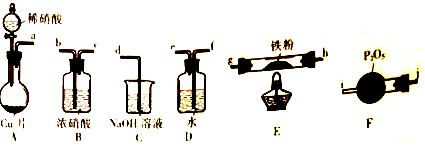
题目内容
2.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 标准状况下,2.24L丁烷中C-C键数目为0.4NA | |
| B. | 0.1mol葡萄糖分子中官能团数目为0.6NA | |
| C. | 28g N2和NO组成的混合物中分子数目可能为0.9NA | |
| D. | 1L pH=13的NaOH溶液中,Na+数目为0.1NA |
分析 A.丁烷分子中含有3个碳碳键;
B.葡萄糖分子中含有5个羟基、1个醛基,总共含有6个官能团;
C.当完全为NO时含有分子数最少,利用极值法判断;
D.没有告诉温度,无法计算氢氧化钠的浓度.
解答 解:A.标况下2.24L丁烷的物质的量为0.1mol,0.1mol丁烷分子中含有0.3mol碳碳键,含有C-C键数目为0.3NA,故A错误;
B.0.1mol葡萄糖分子中含有0.5mol羟基、0.1mol醛基,总共含有0.6mol官能团,含有官能团数目为0.6NA,故B正确;
C.28g N2和NO组成的混合物中,若完全为NO时含有分子数最少,则含有分子的物质的量一定大于:$\frac{28}{30g/mol}$=0.93mol,则该混合物中含有的分子数目一定大于0.9NA,故C错误;
D.温度影响水的离子积,题中缺少温度,无法计算氢氧化钠的物质的量浓度及物质的量,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
10.化学在生产和日常生活中有着重要作用,下列有关说法不正确的是( )
| A. | 硅酸钠的水溶液俗称水玻璃,可用作木材防火剂 | |
| B. | “地沟油”禁止食用,但可以用来制肥皂 | |
| C. | 用聚乙烯塑料代替聚乳酸塑料可减少白色污染 | |
| D. | 利用粮食酿酒经过了淀粉→葡糖糖→乙醇的化学变化过程 |
17.有关胶体与溶液的说法正确的是( )
| A. | 胶体粒子带电,溶液溶质粒子不带电 | |
| B. | 渗析实验可以鉴别胶体和溶液 | |
| C. | 胶体与溶液都可以通过滤纸、半透膜和分子筛 | |
| D. | 丁达尔效应可以区分胶体和溶液 |
7.下列过程均有沉淀生成,其中属于化学变化的是( )
| A. | 向蛋白质溶液中加入浓氯化铁溶液 | |
| B. | 两种不同品牌的墨水混合 | |
| C. | 向饱和BaSO4溶液中加入浓BaCl2溶液 | |
| D. | 向饱和Na2CO3溶液中通入CO2气体 |
1.现有下列八种物质:①H2 ②铝 ③Na2O ④SO2 ⑤HNO3 ⑥KNO3⑦(NH4)2SO4⑧NaCl溶液
(1)按物质的分类方法填写表格的空白处:
(2)写出(NH4)2SO4在水中的电离方程式:(NH4)2SO4═2NH4++SO42-.
(1)按物质的分类方法填写表格的空白处:
| 分类标准 | 金属单质 | 碱性氧化物 | 硝酸盐 | 非电解质 |
| 属于该类的物质(填序号) | ② | ③ | ⑥ | ④ |
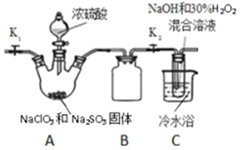 亚氯酸钠(NaClO2)和ClO2都是重要的漂白剂.通常情况下,ClO2是一种具有强氧化性的黄色气体,常用于水的净化和纸浆、纺织品的漂白.ClO2易发生爆炸,在生产、使用时可用其它气体进行稀释.ClO2易与碱反应生成亚氯酸盐和氯酸盐.
亚氯酸钠(NaClO2)和ClO2都是重要的漂白剂.通常情况下,ClO2是一种具有强氧化性的黄色气体,常用于水的净化和纸浆、纺织品的漂白.ClO2易发生爆炸,在生产、使用时可用其它气体进行稀释.ClO2易与碱反应生成亚氯酸盐和氯酸盐.