题目内容
6.某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究.(1)提出假设:①该反应的气体产物是CO2.②该反应的气体产物是CO.
③该反应的气体产物是CO2、CO的混合物
设计方案如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比.
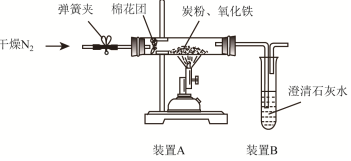
(2)查阅资料
氮气不与碳、氧化铁发生反应.实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气.请写出该反应的离子方程式:NH4++NO2-$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O.
(3)实验步骤
①按图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气.冷却至室温,称得硬质玻璃棒和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g.
(4)数据处理
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:5C+2Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$4Fe+4CO+CO2↑.
(5)实验反思
学习学习小组有同学认为应对实验装置进一步完善.
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是氢氧化钡的溶解度大,浓度大,使二氧化碳被吸收的更完全,碳酸钡的相对原子质量大于碳酸钙的,称量时相对误差小
②此装置存在一定缺陷,请你指出在尾气口处加一点燃的酒精灯.
分析 (1)根据假设①②可以得出假设③的内容;
(2)氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应可以制得氮气;
(4)根据质量守恒判断气体的组成,根据质量关系计算气体的物质的量之间的关系,进而书写化学方程式;
(5)①根据氢氧化钙和氢氧化钡的本质区别来思考;
②一氧化碳是一种有毒气体,可以通过点燃来进行尾气处理.
解答 解:(1)过量炭粉与氧化铁反应的气体产物可能有:①CO、②CO2、③CO2、CO的混合物;
故答案为:CO2、CO的混合物;
(2)氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气,反应物有NH4Cl和NaNO2,生成物为N2,根据质量守恒还应用水,则反应的离子方程式为NH4++NO2-$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O;
故答案为:NH4++NO2-$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O;
(4)3.20g氧化铁的物质的量为=3.2g÷160g/mol=0.02mol,澄清石灰水变浑浊,说明有CO2气体生成,
则n(CO2)=n(CaCO3)=2.0g÷100g/mol=0.02mol,m(CO2)=0.02mol×44g/mol=0.88g,
反应后硬质玻璃管和固体总质量变化为1.44g大于0.88g,则生成其气体为CO2、CO的混合物,混合气体中含有CO0.08mol,所以CO、CO2的混合气体物质的量比为4:1,所以方程式为5C+2Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$4Fe+4CO+CO2↑;
故答案为:5C+2Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$4Fe+4CO+CO2↑;
(5)①将澄清石灰水换成Ba(OH)2溶液,这样会使二氧化碳被吸收的更完全,称量时相对误差小;
故答案为:氢氧化钡的溶解度大,浓度大,使二氧化碳被吸收的更完全,碳酸钡的相对原子质量大于碳酸钙的,称量时相对误差小;
②一氧化碳是一种有毒气体,可以通过点燃来进行尾气处理;
故答案为:在尾气口处加一点燃的酒精灯.
点评 本题考查物质的制备,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力的考查,注意把握题给信息,结合物质的性质解题,题目难度不大.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案| A. | 向蛋白质溶液中加入浓氯化铁溶液 | |
| B. | 两种不同品牌的墨水混合 | |
| C. | 向饱和BaSO4溶液中加入浓BaCl2溶液 | |
| D. | 向饱和Na2CO3溶液中通入CO2气体 |
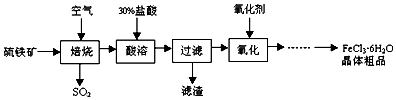
| A. | “焙烧”反应中,氧化产物是SO2,还原产物是Fe3O4 | |
| B. | “酸溶”时的酸可以用稀硫酸代替 | |
| C. | “过滤“后的滤液中Fe3+和Fe2+的浓度比为2:1 | |
| D. | “氧化”时的氧化剂只能选取Cl2 |
| A. | 溶液、分散系 | B. | 氧化物、化合物 | C. | 溶液、胶体 | D. | 化合物、电解质 |
(1)按物质的分类方法填写表格的空白处:
| 分类标准 | 金属单质 | 碱性氧化物 | 硝酸盐 | 非电解质 |
| 属于该类的物质(填序号) | ② | ③ | ⑥ | ④ |
| A. | FeCl2溶液中通入Cl2:Fe2++Cl2→Fe3++2Cl- | |
| B. | H2S通入CuSO4溶液中:Cu2++S2-→CuS↓ | |
| C. | FeS固体放人稀盐酸溶液中:FeS+2H+→Fe2++H2S↑ | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-→AlO2-+2H2O |
| A. | x=0.3a,2Fe2++Cl2→2Fe3++2Cl- | |
| B. | x=0.7a,2Br-+Cl2→Br2+2Cl- | |
| C. | x=1.2a,2Fe2++2Br-+2Cl2→Br2+2Fe3++4Cl- | |
| D. | x=1.5a,2Fe2++4Br-+3Cl2→2Br2+2Fe3++6Cl- |
| A. | 向硫酸铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 将铜丝插入足量浓硝酸中:Cu+8H++2NO3-═3Cu2++2NO2↑+H2O | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+2AlO2-+3H2O═2Al(OH)3↓+CO32- |