题目内容
16.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )| A. | 11.2L氧气所含的原子数为NA | |
| B. | 2.3g金属钠变为钠离子得到0.1NA电子 | |
| C. | 0.5mol/LH2SO4中的H+数为NA | |
| D. | 常温常压下32g O2与O3的混合物含有的氧原子数为2NA |
分析 A.没有告诉在标准状况下,不能使用标况下的气体摩尔体积计算;
B.钠为活泼金属,反应中失去电子;
C.缺少溶液体积,无法计算溶液中氢离子数目;
D.氧气和臭氧都只含有氧元素,根据n=$\frac{m}{M}$计算出混合物中含有氧原子的物质的量.
解答 解:A.不是标况下,不能使用标况下的气体摩尔体积计算氧气的物质的量,故A错误;
B.2.3g金属Na的物质的量为0.1mol,0.1mol钠变为钠离子失去0.1NA个电子,故B错误;
C.没有告诉的体积,无法计算0.5mol/LH2SO4中氢离子的物质的量及数目,故C错误;
D.32g O2与O3的混合物中含有32gO原子,含有氧原子的物质的量为:$\frac{32g}{16g/mol}$=2mol,含有的氧原子数为2NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件,试题有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
17.有关胶体与溶液的说法正确的是( )
| A. | 胶体粒子带电,溶液溶质粒子不带电 | |
| B. | 渗析实验可以鉴别胶体和溶液 | |
| C. | 胶体与溶液都可以通过滤纸、半透膜和分子筛 | |
| D. | 丁达尔效应可以区分胶体和溶液 |
7.CO2可用于合成二甲醚(CH3OCH3),有关反应的热化学方程式如下:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,
2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1,
则CO2与H2反应合成二甲醚的热化学方程式正确的是( )
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,
2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1,
则CO2与H2反应合成二甲醚的热化学方程式正确的是( )
| A. | 2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=-121.5kJ•mol-1 | |
| B. | 2CO2(g)+3H2(g)═$\frac{1}{2}$CH3OCH3(g)+$\frac{3}{2}$H2O(g)△H=-25.5kJ•mol-1 | |
| C. | 2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=+121.5kJ•mol-1 | |
| D. | 2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=-72.5kJ•mol-1. |
4.下列物质在常温下可用铝或铁的容器贮存的是( )
| A. | 浓硫酸 | B. | 稀硝酸 | C. | 王水 | D. | 硫酸铜 |
1.现有下列八种物质:①H2 ②铝 ③Na2O ④SO2 ⑤HNO3 ⑥KNO3⑦(NH4)2SO4⑧NaCl溶液
(1)按物质的分类方法填写表格的空白处:
(2)写出(NH4)2SO4在水中的电离方程式:(NH4)2SO4═2NH4++SO42-.
(1)按物质的分类方法填写表格的空白处:
| 分类标准 | 金属单质 | 碱性氧化物 | 硝酸盐 | 非电解质 |
| 属于该类的物质(填序号) | ② | ③ | ⑥ | ④ |
8.大量生产金属单质铁和铝的方法是( )
| A. | 加热法和还原法 | B. | 还原法和加热法 | C. | 还原法和电解法 | D. | 电解法和还原法 |
5.已知两瓶气体,分别是HCl和Cl2.可以区别它们的方法或试剂是( )
①观察颜色
②打开瓶盖看有无白雾
③湿润的淀粉试纸
④湿润的红色石蕊试纸
⑤湿润的蓝色石蕊试纸 ⑥硝酸银溶液.
①观察颜色
②打开瓶盖看有无白雾
③湿润的淀粉试纸
④湿润的红色石蕊试纸
⑤湿润的蓝色石蕊试纸 ⑥硝酸银溶液.
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ①②④⑤ | D. | ①②④⑥ |
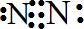 ;将空气中的氮气转化为氮的化合物的过程称为固氮,下列能实现人工固氮的是D
;将空气中的氮气转化为氮的化合物的过程称为固氮,下列能实现人工固氮的是D