题目内容
12.酸雨是指( )| A. | pH<7的雨水 | B. | pH<5.6的雨水 | C. | pH=5.6的雨水 | D. | pH>7的雨水 |
分析 正常雨水溶解二氧化碳,其pH为5.6,而溶解二氧化硫的雨水为酸雨,以此来解答.
解答 解:溶解二氧化硫的雨水为酸雨,二氧化硫与水反应生成亚硫酸,亚硫酸被氧化生成硫酸,则酸性增强,酸雨的pH<5.6,
故选B.
点评 本题考查酸雨,为高频考点,把握酸雨的形成原因为解答的关键,注意正常雨水与酸雨pH的区别,题目难度不大.

练习册系列答案
相关题目
7.CO2可用于合成二甲醚(CH3OCH3),有关反应的热化学方程式如下:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,
2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1,
则CO2与H2反应合成二甲醚的热化学方程式正确的是( )
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,
2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1,
则CO2与H2反应合成二甲醚的热化学方程式正确的是( )
| A. | 2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=-121.5kJ•mol-1 | |
| B. | 2CO2(g)+3H2(g)═$\frac{1}{2}$CH3OCH3(g)+$\frac{3}{2}$H2O(g)△H=-25.5kJ•mol-1 | |
| C. | 2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=+121.5kJ•mol-1 | |
| D. | 2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=-72.5kJ•mol-1. |
17.某校化学课题组探究以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3•6H2O)的工艺,他们设计的流程如图所示,在“焙烧“过程中铁元素转 为 Fe3O4.下列推断正确的是( )
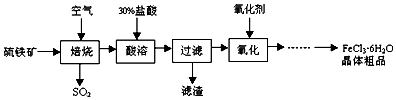

| A. | “焙烧”反应中,氧化产物是SO2,还原产物是Fe3O4 | |
| B. | “酸溶”时的酸可以用稀硫酸代替 | |
| C. | “过滤“后的滤液中Fe3+和Fe2+的浓度比为2:1 | |
| D. | “氧化”时的氧化剂只能选取Cl2 |
4.下列物质在常温下可用铝或铁的容器贮存的是( )
| A. | 浓硫酸 | B. | 稀硝酸 | C. | 王水 | D. | 硫酸铜 |
1.现有下列八种物质:①H2 ②铝 ③Na2O ④SO2 ⑤HNO3 ⑥KNO3⑦(NH4)2SO4⑧NaCl溶液
(1)按物质的分类方法填写表格的空白处:
(2)写出(NH4)2SO4在水中的电离方程式:(NH4)2SO4═2NH4++SO42-.
(1)按物质的分类方法填写表格的空白处:
| 分类标准 | 金属单质 | 碱性氧化物 | 硝酸盐 | 非电解质 |
| 属于该类的物质(填序号) | ② | ③ | ⑥ | ④ |
2.下列有关说法正确的是( )
| A. | 能在水溶液或熔融状态下导电的物质是电解质 | |
| B. | 电离出氢离子的化合物是酸 | |
| C. | 氧化还原反应中转移电子数等于得电子数与失电子数加和 | |
| D. | 丁达尔效应可用来区别溶液和胶体 |