题目内容
11.工业上常用如图的方法从海水中提碘:
完成下列填空:
(1)上述流程中有两步都涉及到氯气.写出氯元素在周期表中的位置:第三周期第ⅦA族;氯气分子中所含的化学键名称是:共价键;在37Cl原子钟,其核外存在17种运动状态不同的电子.
(2)和氯元素位于同主族的另外一个短周期元素单质的电子式是:
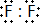 ,两者气态氢化物的稳定性是:HF>HCl(填写化学式).
,两者气态氢化物的稳定性是:HF>HCl(填写化学式).(3)步骤②中体现了溴具有的性质是沸点低,易挥发(文字简述).
(4)写出步骤③中反应的化学方程式(说明:此反应在水溶液中进行):Br2+SO2+2H2O→H2SO4+2HBr;在该反应中被氧化的元素是:S.
(5)工业上利用海水还有一个重要的反应就是电解饱和食盐水,此反应中的阴极产物是:H2
和NaOH(写化学式).
(6)溴蒸汽还可以用饱和碳酸钠溶液来吸收,产物为溴化钠、溴酸钠,同时放出二氧化碳,请写出该反应的化学方程式并标明电子转移方向与数目:
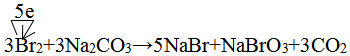 .
.
分析 浓缩后增大溴离子的浓度,与氯气发生2Br-+C12=Br2+2Cl-,用空气和水蒸气将溴吹出,并用SO2氧化吸收,从而达到富集溴,③中发生Br2+2H2O+SO2═2HBr+H2SO4,④中发生Cl2+2HBr=Br2+2HCl,
(1)氯元素核电荷数17,原子核外三个电子层,最外层电子数7个,据此得到周期表位置,氯气分子中氯原子间相处一对共用电子对,氯原子核外17个电子;
(2)和氯元素位于同主族的另外一个短周期元素单质为F2,氟原子间形成一对共用电子对,非金属性越强氢化物稳定性越强;
(3)步骤②中体现了溴具有的性质是易挥发性;
(4)步骤③中反应是溴单质和二氧化硫在水溶液中发生氧化还原反应生成硫酸和溴化氢,反应中被氧化的元素是元素化合价升高的元素;
(5)电解饱和食盐水溶液中氯离子在阳极失电子被氧化生成氯气,氢离子在阴极得到电子生成氢气被还原,水电离平衡正向进行,溶液中氢氧根离子浓度增大;
(6)吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出,生成溴化钠和溴酸钠,在酸溶液中会反应归中反应.
解答 解:(1)氯元素核电荷数17,原子核外三个电子层,最外层电子数7个,位于周期表中第三周期第ⅤⅡA,氯气分子中氯原子间相处一对共用电子对,形成一个共价键,氯原子核外17个电子,其核外存在17种运动状态不同的电子,
故答案为:第三周期第ⅤⅡA;共价键;17;
(2)和氯元素位于同主族的另外一个短周期元素单质为F2,氟原子间形成一对共用电子对,电子式为,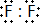 ,非金属性越强氢化物稳定性越强,两者气态氢化物的稳定性是HF>HCl,
,非金属性越强氢化物稳定性越强,两者气态氢化物的稳定性是HF>HCl,
故答案为: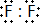 ;HF;HCl;
;HF;HCl;
(3)步骤②中用空气和水蒸气将溴吹出,并用SO2氧化吸收,从而达到富集溴,体现了溴具有的性质是沸点低,易挥发,
故答案为:沸点低,易挥发;
(4)步骤③中反应是溴单质和二氧化硫在水溶液中发生氧化还原反应生成硫酸和溴化氢,反应的化学方程式为:Br2+SO2+2H2O=H2SO4+2HBr,反应中被氧化的元素是S元素,化合价+4价变化为+6价,
故答案为:Br2+SO2+2H2O=H2SO4+2HBr;S;
(5)电解饱和食盐水溶液中氯离子在阳极失电子被氧化生成氯气,氢离子在阴极得到电子生成氢气被还原,水电离平衡正向进行,溶液中氢氧根离子浓度增大溶液中生成氢氧化钠,
故答案为:H2;NaOH;
(6)吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出,反应的化学方程式为:3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑,溴元素0价变化为-1价和+5价,电子转移总数5e-,该反应的化学方程式并标明电子转移方向与数目为: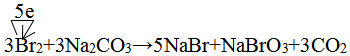 ,
,
故答案为: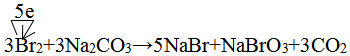 .
.
点评 本题考查了离子性质的应用,混合物除杂的实验方案分析,氧化还原反应的强弱规律应用,归中反应的分析判断,离子方程式的书写方法,题目难度中等.

(1)按物质的分类方法填写表格的空白处:
| 分类标准 | 金属单质 | 碱性氧化物 | 硝酸盐 | 非电解质 |
| 属于该类的物质(填序号) | ② | ③ | ⑥ | ④ |
| A. | 能在水溶液或熔融状态下导电的物质是电解质 | |
| B. | 电离出氢离子的化合物是酸 | |
| C. | 氧化还原反应中转移电子数等于得电子数与失电子数加和 | |
| D. | 丁达尔效应可用来区别溶液和胶体 |
| A. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | B. | NH3+HCl═NH4Cl | ||
| C. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | D. | H2SO4+2NaOH═Na2SO4+2H2O |
| A. | 向硫酸铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 将铜丝插入足量浓硝酸中:Cu+8H++2NO3-═3Cu2++2NO2↑+H2O | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+2AlO2-+3H2O═2Al(OH)3↓+CO32- |
| A. | SO2使品红溶液褪色 | B. | 氯水使紫色石蕊试液褪色 | ||
| C. | SO2使高锰酸钾溶液褪色 | D. | 活性炭使比墨水褪色 |
| A. | ①不变浑浊,②变浑浊 | B. | ①变浑浊,②不变浑浊 | ||
| C. | ①变浑浊,②变浑浊 | D. | ①不变浑浊,②变浅黄色 |