题目内容
18.下列实验的操作或所用的试剂有错误的是( )| A. | 实验室制取乙烯气体时,将温度计的水银球放入液面以下 | |
| B. | 可用酒精洗涤沾有苯酚的试管 | |
| C. | 证明分子CH2=CH-CHO既含有醛基又含有碳碳双键,可先向溶液中先加入足量的银氨溶液加热,充分反应后,再加入足量的溴水 | |
| D. | 苯中混有苯酚,加浓溴水,然后过滤 |
分析 A.实验室制取乙烯气体时,测定反应液的温度;
B.苯酚易溶于酒精;
C.-CHO能被银氨溶液氧化,而C=C不能;
D.苯酚和浓溴水发生取代反应生成三溴苯酚沉淀,三溴苯酚沉淀、苯酚和苯互溶.
解答 解:A.实验室制取乙烯气体时,测定反应液的温度,所以温度计伸入反应液中,故A正确;
B.苯酚易溶于酒精,所以可以用酒精洗涤沾有苯酚的试管,故B正确;
C.-CHO能被银氨溶液氧化,而C=C不能,所以可以用银氨溶液检验醛基,故C正确;
D.苯酚和浓溴水发生取代反应生成三溴苯酚沉淀,三溴苯酚沉淀、苯酚和苯互溶,所以不能用浓溴水除杂,应该用NaOH溶液除杂,然后采用分液方法分离,故D错误;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及仪器的使用、官能团检验、除杂等知识点,明确实验原理及性质是解本题关键,注意利用物质性质差异性鉴别物质,易错选项是C,注意不能用溴水或酸性高锰酸钾溶液鉴别碳碳双键和醛基.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
5.某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )
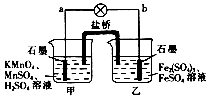

| A. | b电极上发生还原反应 | |
| B. | 甲烧杯中溶液的pH逐渐减小 | |
| C. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| D. | 外电路的电流方向是从a到b |
9.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1mol•L-1NaHCO3溶液:H+、Al3+、Cl-、CH3COO- | |
| B. | 0.1mol•L-1CuCl2溶液:K+、NH4+、OH-、S2- | |
| C. | 0.1mol•L-1FeCl2溶液:Na+、NH4+、I-、SO42- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1013的溶液:Fe3+、Na+、SO32ˉ、NO3- |
6.室温时,将浓度和体积分别为C1、V1的NaOH溶液和C2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是( )
| A. | 若pH>7时,则一定是C1V1>C2V2 | |
| B. | 若pH<7时,混合溶液中可能有c(Na+)>c(H+) | |
| C. | 当pH=7时,若V1=V2,则一定是C2=C1 | |
| D. | 若 V1=V2,C1=C2,则c(CH3COO-)+c(CH3COOH)=c(Na+) |
13.(1)室温下,有一pH=12的NaOH溶液100mL,欲使它的pH降为11.
①如果加入蒸馏水,就加入900 mL
②如果加入pH=10的NaOH溶液,应加入1000 mL
③如果加入0.008mol/L HCl溶液,应加入100 mL
(2)实验室在配制溶液时,一些物质存在水解的情况,如在配制Na2CO3溶液时,CO32-会水解,请书写水解离子方程式CO32-+H2O?HCO3-+OH-,在配制Al2(SO4)3溶液时,Al3+也存在水解,请书写水解离子方程式Al3++3H2O?Al(OH)3+3H+,为了防止Al2(SO4)3发生水解,可加入少量的硫酸.
(3)工业上用氧化铜制备氯化铜时,先将制的氧化铜(含有杂质FeO)用浓酸溶解得到的氯化铜(溶液中含有一定量的Fe2+).
实际生产中先用次氯酸钠将Fe2+氧化成Fe3+,然后用试剂CuO或Cu(OH)2将溶液PH值调至3.7~4.4,即可除去铁杂质.
①如果加入蒸馏水,就加入900 mL
②如果加入pH=10的NaOH溶液,应加入1000 mL
③如果加入0.008mol/L HCl溶液,应加入100 mL
(2)实验室在配制溶液时,一些物质存在水解的情况,如在配制Na2CO3溶液时,CO32-会水解,请书写水解离子方程式CO32-+H2O?HCO3-+OH-,在配制Al2(SO4)3溶液时,Al3+也存在水解,请书写水解离子方程式Al3++3H2O?Al(OH)3+3H+,为了防止Al2(SO4)3发生水解,可加入少量的硫酸.
(3)工业上用氧化铜制备氯化铜时,先将制的氧化铜(含有杂质FeO)用浓酸溶解得到的氯化铜(溶液中含有一定量的Fe2+).
| 金属离子 | PH值 | |
| 开始沉淀 | 完全沉淀 | |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.4 | 6.4 |
| Fe3+ | 2.7 | 3.7 |
3.下列叙述正确的是( )
| A. | 在中和热的测定实验中,应将碱液缓慢倒入酸液中,使反应充分进行 | |
| B. | 用NaOH标准溶液滴定醋酸溶液至中性时,醋酸则被完全中和 | |
| C. | 将Na2S2O3溶液和稀硫酸混合,可通过观察产生气泡的快慢来判断化学反应速率 | |
| D. | 将铁钉放试管中,加入2mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,不久铁钉周围出现蓝色沉淀 |
10.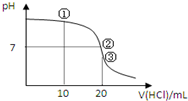 常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲线如图.下列说法正确的是( )
常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲线如图.下列说法正确的是( )
 常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲线如图.下列说法正确的是( )
常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲线如图.下列说法正确的是( )| A. | ①溶液:c(C1-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | ②溶液:c(NH4+)>c(C1-)>c(OH-)=c(H+) | |
| C. | ③溶液:c(H+)>c(NH3•H2O)+c(OH-) | |
| D. | 滴定过程中可能出现:c(NH3•H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
7.下列说法不正确的是( )
| A. | 将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 | |
| B. | 乙酸乙酯的制备实验中,饱和Na2CO3溶液不仅可以降低乙酸乙酯的溶解度,还能吸收挥发出来的乙醇及乙酸 | |
| C. | “中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 | |
| D. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
8.100℃时,KW=1.0×10-12,若在100℃时某溶液中的c(H+)=1.0×10-7 mol•L-1,则该溶液( )
| A. | 呈中性 | B. | 呈碱性 | C. | 呈酸性 | D. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1 |