题目内容
14.洗涤下列仪器时,选用的试剂(括号中的物质)不正确的是( )| A. | 做过木炭还原氧化铜实验的硬质玻璃管(盐酸) | |
| B. | 长期存放氯化铁溶液的试剂瓶(稀硫酸) | |
| C. | 做过碘升华实验的试管(酒精) | |
| D. | 沾有油污的烧杯(纯碱溶液) |
分析 A.铜与盐酸不反应;
B.三氯化铁长期存放水解生成氢氧化铁;
C.碘易溶于酒精;
D.油污在碱性条件下能水解.
解答 解:A.铜与盐酸不反应,应用稀硝酸,故A错误;
B.三氯化铁长期存放水解生成氢氧化铁,氢氧化铁能与硫酸反应,故B正确;
C.碘易溶于酒精,可清洗,故C正确;
D.油污在碱性条件下能水解,则用纯碱溶液洗涤沾有油污的器具,故D正确.
故选A.
点评 本题考查仪器的洗涤,物质的性质决定了物质的用途,熟练掌握物质的性质是解题的关键,题目难度不大.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案
相关题目
4.在烃的分子中去掉2个氢原子形成一个双键是吸热反应,大约需要117kJ/mol~125kJ/mol的热量,但1,3-环己二烯失去2个氢原子变成苯是放热反应,反应热为23.4kJ/mol.以上事实表明( )
| A. | 1,3-环己二烯加氢是吸热反应 | |
| B. | 完全燃烧时1,3-环己二烯比苯放热多 | |
| C. | 苯加氢生成环己烷是吸热反应 | |
| D. | 苯比1,3-环己二烯稳定 |
5.某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )


| A. | b电极上发生还原反应 | |
| B. | 甲烧杯中溶液的pH逐渐减小 | |
| C. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| D. | 外电路的电流方向是从a到b |
2.已知氯化铁溶液与碘化钾溶液混合时发生反应:2Fe3+(aq)+2I-(aq)=2Fe2+(aq)+I2(s).现将1 L 0.25mol•L-1氯化铁溶液与4 L 0.10 mol•L-碘化钾溶液混合后,在第2min时.测得混合溶液中c(I-)=0.04 mo1•L-.则下列说法正确的是( )
| A. | 第2min时,c(Fe2+)=0.01 mol•L-1 | |
| B. | 混合溶液中,c(K+)=0.01 mol•L-1 | |
| C. | 0~2min内,v(I-)=0.01 mol•L-1•min-1 | |
| D. | 第2min时,c(Fe3+)=0.01 mol•L-1 |
9.短周期主族元素X、Y、Z在元素周期表中的相对位置如图所示,下列说法一定正确的是( )

| A. | 最高正化合价:Z>X | |
| B. | X、Y、Z的单质中,Z的熔点最高 | |
| C. | 若X为非金属元素,则离子半径:Xn->Ym->Zm- | |
| D. | X、Y、Z的最高价氧化物对应水化物中,Y的碱性最强 |
2. 想用0.1000mol•L-1NaOH溶液通过中和滴定测定盐酸溶液的物质的量浓度,回答下列问题.
想用0.1000mol•L-1NaOH溶液通过中和滴定测定盐酸溶液的物质的量浓度,回答下列问题.
(1)0.1000mol•L-1NaOH溶液中由水电离出的c(OH)-=1×10-13mol•L-1
(2)滴定时用酸式(填“酸式”或“碱式”)滴定管将待测液移入锥形瓶中.
(3)若滴定时选用的指示剂是酚酞,则终点的想象是滴入最后一滴NaOH标准液,溶液由无色变为粉红色,且半分钟内不褪色
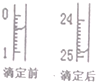
(4)中和滴定有关数据记录如下表,如图表示下表中第1次滴定时50mL滴定管中前后液面的位置
则表中z=24.50mL
(5)根据所给数据,盐酸溶液的物质的量浓度c=0.1020mol•L-1(保留四位有效数字)
(6)下列操作会使测定结果偏高的有ad
a.洗涤碱式滴定管时未用装溶液润洗
b.洗涤时锥形瓶只用蒸馏水洗净后而未润洗
c.读所用标准液体积时,滴定前仰视,滴定后仰视
d.滴定时标准液不小心滴入到锥形瓶外面.
 想用0.1000mol•L-1NaOH溶液通过中和滴定测定盐酸溶液的物质的量浓度,回答下列问题.
想用0.1000mol•L-1NaOH溶液通过中和滴定测定盐酸溶液的物质的量浓度,回答下列问题.(1)0.1000mol•L-1NaOH溶液中由水电离出的c(OH)-=1×10-13mol•L-1
(2)滴定时用酸式(填“酸式”或“碱式”)滴定管将待测液移入锥形瓶中.
(3)若滴定时选用的指示剂是酚酞,则终点的想象是滴入最后一滴NaOH标准液,溶液由无色变为粉红色,且半分钟内不褪色
(4)中和滴定有关数据记录如下表,如图表示下表中第1次滴定时50mL滴定管中前后液面的位置
| 滴定序号 | 待测液体积(mL) | 所消耗NaOH标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 25.00 | x | y | z |
| 2 | 25.00 | 4.00 | 29.60 | 25.60 |
| 3 | 25.00 | 0.60 | 26.00 | 25.40 |
(5)根据所给数据,盐酸溶液的物质的量浓度c=0.1020mol•L-1(保留四位有效数字)
(6)下列操作会使测定结果偏高的有ad
a.洗涤碱式滴定管时未用装溶液润洗
b.洗涤时锥形瓶只用蒸馏水洗净后而未润洗
c.读所用标准液体积时,滴定前仰视,滴定后仰视
d.滴定时标准液不小心滴入到锥形瓶外面.
9.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1mol•L-1NaHCO3溶液:H+、Al3+、Cl-、CH3COO- | |
| B. | 0.1mol•L-1CuCl2溶液:K+、NH4+、OH-、S2- | |
| C. | 0.1mol•L-1FeCl2溶液:Na+、NH4+、I-、SO42- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1013的溶液:Fe3+、Na+、SO32ˉ、NO3- |
6.室温时,将浓度和体积分别为C1、V1的NaOH溶液和C2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是( )
| A. | 若pH>7时,则一定是C1V1>C2V2 | |
| B. | 若pH<7时,混合溶液中可能有c(Na+)>c(H+) | |
| C. | 当pH=7时,若V1=V2,则一定是C2=C1 | |
| D. | 若 V1=V2,C1=C2,则c(CH3COO-)+c(CH3COOH)=c(Na+) |
7.下列说法不正确的是( )
| A. | 将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 | |
| B. | 乙酸乙酯的制备实验中,饱和Na2CO3溶液不仅可以降低乙酸乙酯的溶解度,还能吸收挥发出来的乙醇及乙酸 | |
| C. | “中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 | |
| D. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |