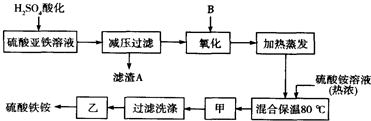
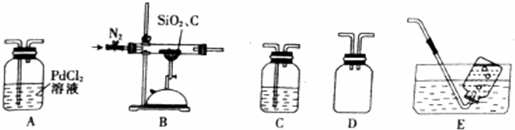
题目内容
17.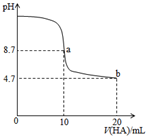 室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液,pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液,pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | a、b两点所示溶液中水的电离程度相同 | |
| C. | b点所示溶液中c(A-)>c(HA) | |
| D. | 滴定过程中不可能出现c(Na+)>c(OH-)>c(A-)>c(H+) |
分析 室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,a点酸碱的物质的量相等,二者恰好反应生成NaA,但溶液呈碱性,说明生成的盐是强碱弱酸盐,则HA是弱酸;
要使混合溶液呈中性,则HA应该稍微过量,所以b点HA体积大于10mL,c点溶液中溶质为等物质的量浓度的NaA、HA,溶液呈酸性,说明HA电离程度大于A-水解程度;
A.a点时酸碱恰好中和,溶液pH=8.7,说明HA为弱酸,NaA溶液水解呈碱性;
B.b点时HA过量,溶液呈酸性,HA电离出H+,抑制水的电离;
C.b点HA过量一倍,溶液存在NaA和HA,溶液呈酸性,说明HA电离程度大于A-水解程;
D.刚开始加HA时,溶液中剩余大量NaOH,则c(OH-)>c(A-).
解答 解:室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,a点酸碱的物质的量相等,二者恰好反应生成NaA,但溶液呈碱性,说明生成的盐是强碱弱酸盐,则HA是弱酸;
要使混合溶液呈中性,则HA应该稍微过量,所以b点HA体积大于10mL,c点溶液中溶质为等物质的量浓度的NaA、HA,溶液呈酸性,说明HA电离程度大于A-水解程度;
A.a点时酸碱恰好中和,溶液pH=8.7,说明HA为弱酸,NaA溶液水解呈碱性,水解生成的HA的浓度大于水电离的氢离子浓度,所以c(HA)>c(H+),故A错误;
B.a点A-水解,促进水的电离,b点时HA过量,溶液呈酸性,HA电离出H+,抑制水的电离,所以a、b两点所示溶液中水的电离程度相同不同,故B错误;
C.b点HA过量一倍,溶液存在NaA和HA,溶液呈酸性,说明HA电离程度大于A-水解程度,则存在c(A-)>c(HA),故C正确;
D.刚开始加HA时,溶液中剩余大量NaOH,则c(OH-)>c(A-),所以溶液中存在c(Na+)>c(OH-)>c(A-)>c(H+),故D错误;
故选C.
点评 本题以酸碱混合溶液定性判断为载体考查离子浓度大小比较,题目难度中等,明确各点溶液中溶质及其性质是解本题关键,注意任何电解质溶液中都存在电荷守恒,与溶液酸碱性无关.

| A. | 放电时,负极的电极反应式:Li-e-═Li+ | |
| B. | 充电时,LiFePO4既发生氧化反应又发生还原反应 | |
| C. | 该电池不能用水溶液作为电解质 | |
| D. | 放电过程中Li+向负极移动 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | BaSO4的电离程度减小 | B. | BaSO4溶解的量减小 | ||
| C. | c(Ba2+)与c(SO42-)的乘积增大 | D. | 溶液的导电能力增强 |
| A. | 若a≤b,则混合溶液的pH大于7 | |
| B. | 若a=2b,溶液呈酸性,则[CH3COO-]>[Na+]>[CH3COOH]>[H+]>[OH-] | |
| C. | 混合溶液中[Na+]+[H+]=[OH-]+[CH3COO-]一定成立 | |
| D. | 混合溶液中[CH3COO-]+[CH3COOH]=a mol/L 一定成立 |
| A. | 0.1 mol•L-1的盐酸与0.1 mol•L-1的氨水混合,若溶液显中性,则V(盐酸)<V(氨水) | |
| B. | 0.1 mol•L-1的醋酸与等浓度等体积NaOH反应后的溶液中,CH3COOH和CH3COO-浓度关系为:c(CH3COOH)+c(CH3COO-)=0.1 mol•L-1 | |
| C. | pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则V(盐酸)>V(氨水) | |
| D. | 已知酸性:HCOOH>HCN,等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者 |
| A. | 己烷不能使Br2的四氯化碳溶液褪色而己烯能使其褪色 | |
| B. | 葡萄糖与新制的Cu(OH)2悬浊液共热生成砖红色而果糖不能 | |
| C. | 苯酚( )与溴的水溶液反应生成白色沉淀而甲苯不能 )与溴的水溶液反应生成白色沉淀而甲苯不能 | |
| D. | 乙烷与Cl2单质发生取代反应而乙烯与Cl2单质易发生加成反应 |