题目内容
5.硫酸铁铵[aFe2(SO4)3•b(NH4)2SO4•cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等.某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如图工艺流程制取硫酸铁铵.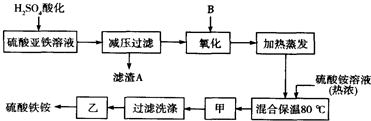
请回答下列问题:
(1)硫酸亚铁溶液加H2SO4酸化的主要目的是增大溶液中SO42-浓度,将Ca2+转化为沉淀或抑制Fe2+水解,滤渣A的主要成分是CaSO4.
(2)下列物质中最适合的氧化剂B是b;反应的离子方程式H2O2+2Fe2++2H+=2Fe3++2H2O.
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲、乙的名称分别是:甲冷却结晶,乙常温晾晒.
(4)上述流程中,氧化之后和加热蒸发之前,需取少量检验Fe2+是否已全部被氧化,所加试剂为铁氰化钾溶液(写名称),能否用酸性的KMnO4溶液?不能(如果能,下问忽略),理由是:因为过氧化氢和二价铁离子均能使酸性高锰酸钾溶液褪色.(可用语言或方程式说明)
(5)检验硫酸铁铵中NH4+的方法是在试管中加入少量样品和NaOH固体加热,在试管口用湿润的红色石蕊试纸检验,看到试纸变成蓝色.
(6)称取14.00g样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14g沉淀;向另一份溶液中加入0.05mol Ba (NO3)2溶液,恰好完全反应.则该硫酸铁铵的化学式为Fe2(SO4)3•2(NH4)2SO4•2H2O.
分析 原料中加入硫酸酸化,可生成硫酸钙沉淀,减压过滤后加入过氧化氢氧化可生成硫酸铁,加入硫酸铵,在80℃下反应可生成硫酸铁铵,经蒸发浓缩、冷却结晶、过滤洗涤,最后经常温晾晒可到纯净的硫酸铁铵,结合对应物质的性质以及题目要求可解答该题.
(1)硫酸亚铁中亚铁离子水解,硫酸可以抑制水解,硫酸根离子可以将钙离子沉淀;
(2)加入氧化剂可氧化亚铁离子,但应避免引入新杂质;
(3)硫酸铁铵经蒸发浓缩、冷却结晶、过滤洗涤,最后经常温晾晒可到纯净的硫酸铁铵,但是温度不能太高;
(4)根据酸性高锰酸钾溶液氧化性很强,可以氧化二价铁和双氧水分析;
(5)检验NH4+的方法是加入强碱反应、加热能够产生使湿润的红色石蕊试液变蓝的气体,该气体是氨气,从而证明原溶液中一定含有NH4+;
(6)根据元素守恒结合发生的转化来计算.
解答 解:原料中加入硫酸酸化,可生成硫酸钙沉淀,减压过滤后加入过氧化氢氧化可生成硫酸铁,加入硫酸铵,在80℃下反应可生成硫酸铁铵,经蒸发浓缩、冷却结晶、过滤洗涤,最后经常温晾晒可到纯净的硫酸铁铵,
(1)加入硫酸,可增大溶液中SO42-浓度,将Ca2+转化为沉淀,生成CaSO4,同时抑制Fe2+水解,
故答案为:增大溶液中SO42-浓度,将Ca2+转化为沉淀或抑制Fe2+水解;CaSO4;
(2)为避免引入新杂质,应加入过氧化氢为氧化剂,还原产物是水,反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O,
故答案为:b;H2O2+2Fe2++2H+=2Fe3++2H2O;
(3)在80℃下反应可生成硫酸铁铵,经蒸发浓缩、冷却结晶、过滤洗涤,最后经常温晾晒可到纯净的硫酸铁铵,温度不能过高,防止分解,
故答案为:冷却结晶;常温晾晒;
(4)酸性高锰酸钾溶液氧化性很强,可以氧化二价铁和双氧水,应加入铁氰化钾溶液,如生成蓝色沉淀,可说明含有亚铁离子,
故答案为:铁氰化钾溶液;不能;因为过氧化氢和二价铁离子均能使酸性高锰酸钾溶液褪色;
(5)检验NH4+的方法是加入强碱反应、加热能够产生使湿润的红色石蕊试液变蓝的气体,该气体是氨气,从而证明原溶液中一定含有NH4+,
故答案为:在试管中加入少量样品和NaOH固体加热,在试管口用湿润的红色石蕊试纸检验,看到试纸变成蓝色;
(6)称取14.00g样品,将其溶于水配置成100mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14g沉淀,应为Fe(OH)3,
n(Fe(OH)3)=$\frac{2.14g}{107g/mol}$=0.02mol,
向另一份溶液中加入0.05mol Ba(NO3)2溶液,恰好完全反应,则n(SO42-)=0.05mol,
所以14.00g样品中含有Fe2(SO4)30.02mol,n(SO42-)为0.1mol,则(NH4)2SO4为0.1mol-0.02mol×3=0.04mol,
则m(H2O)=14.00g-0.02mol×400g/mol-0.04mol×132g/mol=0.72g,
n(H2O)=$\frac{0.72g}{18g/mol}$=0.04mol,
n(Fe2(SO4)3):n((NH4)2SO4):n(H2O)=0.02:0.04:0.04=1:2:2,
所以化学式为Fe2(SO4)3•2(NH4)2SO4•2H2O,
故答案为:Fe2(SO4)3•2(NH4)2SO4•2H2O.
点评 本题考查考查物质的分离、提纯制备,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的考查,注意根据物质的性质把握实验原理和方法,难度较大.

| A. | 8种 | B. | 10种 | C. | 11种 | D. | 12种 |
| A. | 氢有三种同素异形体,分别是氕、氘、氚 | |
| B. | 氢有三种同位素,它们的相对原子质量分别是1、2、3 | |
| C. | 氢元素可形成三种互为通分异构体的物质:H2、D2、T2 | |
| D. | 氢元素的三种同位素原子可用一个原子结构示意图表示 |
| A. | 锌作阳极,铁制品作阴极,溶液中含有锌离子 | |
| B. | 锌作阴极,铁制品作阳极,溶液中含有锌离子 | |
| C. | 锌作阳极,铁制品作阴极,溶液中含有亚铁离子 | |
| D. | 锌作阴极,铁制品作阳极,溶液中含有亚铁离子 |
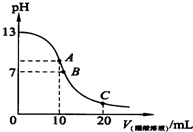
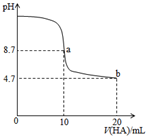 室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液,pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液,pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | a、b两点所示溶液中水的电离程度相同 | |
| C. | b点所示溶液中c(A-)>c(HA) | |
| D. | 滴定过程中不可能出现c(Na+)>c(OH-)>c(A-)>c(H+) |
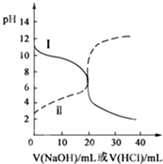 25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )| A. | 曲线Ⅰ:滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | 曲线Ⅰ:滴加溶液到20 mL时:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| C. | 曲线Ⅱ:滴加溶液在10 mL~20 mL之间时:c(NH4+)=c(Cl-)>c(OH-)=c(H+) | |
| D. | 曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
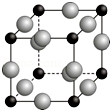 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):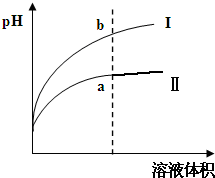
 已知25℃时,0.10mol.L-1的CH3COOH的电离度为1.3%,pH=3.1.
已知25℃时,0.10mol.L-1的CH3COOH的电离度为1.3%,pH=3.1.