题目内容
9.以下说法不正确的是( )| A. | 0.1 mol•L-1的盐酸与0.1 mol•L-1的氨水混合,若溶液显中性,则V(盐酸)<V(氨水) | |
| B. | 0.1 mol•L-1的醋酸与等浓度等体积NaOH反应后的溶液中,CH3COOH和CH3COO-浓度关系为:c(CH3COOH)+c(CH3COO-)=0.1 mol•L-1 | |
| C. | pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则V(盐酸)>V(氨水) | |
| D. | 已知酸性:HCOOH>HCN,等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者 |
分析 A.HCl与氨水恰好完全反应生成氯化铵,显酸性;
B.0.1 mol•L-1的醋酸与等浓度等体积NaOH反应,浓度变为原来的一半;
C.一水合氨在溶液中部分电离,氨水的浓度大于0.001mol/L,HCl的浓度等于0.001mol/L;
D.根据电荷守恒,c(HCOO-)+c(OH-)=c(Na+)+c(H+),c(CN-)+c(OH-)=c(Na+)+c(H+),和水解程度大小分析.
解答 解:A.HCl与氨水恰好完全反应生成氯化铵,显酸性,所以要呈中性,氨水需过量,则V(盐酸)<V(氨水),故A正确;
B.0.1 mol•L-1的醋酸与等浓度等体积NaOH反应,浓度变为原来的一半,所以CH3COOH和CH3COO-浓度关系为:c(CH3COOH)+c(CH3COO-)=0.05 mol•L-1,故B错误;
C.一水合氨在溶液中部分电离,氨水的浓度大于0.001mol/L,HCl的浓度等于0.001mol/L,若二者混合显中性,则V(盐酸)>V(氨水),故C正确;
D.根据电荷守恒,c(HCOO-)+c(OH-)=c(Na+)+c(H+),c(CN-)+c(OH-)=c(Na+)+c(H+),即离子总数是n(Na+ )+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的c(OH-)大,c(H+)小,c(Na+)相同,所以甲酸钠中离子浓度大,故D正确.
故选B.
点评 本题考查了弱电解质的电离,明确弱电解质电离平衡常数与酸性强弱、酸根离子的水解程度的关系是解本题关系,再结合强酸制取弱酸、酸碱中和反应来分析解答,易错选项是D,注意从电荷守恒的角度解答该题.

练习册系列答案
相关题目
11.下列说法不正确的是( )
| A. | 甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 | |
| B. | 蔗糖、麦芽糖的分子式都是C12H22O11,它们互为同分异构体 | |
| C. | “地沟油”可通过水解制得肥皂 | |
| D. | 苯不能使酸性KMnO4溶液褪色,因此苯不能发生氧化反应 |
12.在铁制品上镀上一定厚度的锌层,以下设计方案正确的是( )
| A. | 锌作阳极,铁制品作阴极,溶液中含有锌离子 | |
| B. | 锌作阴极,铁制品作阳极,溶液中含有锌离子 | |
| C. | 锌作阳极,铁制品作阴极,溶液中含有亚铁离子 | |
| D. | 锌作阴极,铁制品作阳极,溶液中含有亚铁离子 |
17.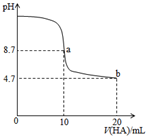 室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液,pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液,pH的变化曲线如图所示.下列说法正确的是( )
 室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液,pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液,pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | a、b两点所示溶液中水的电离程度相同 | |
| C. | b点所示溶液中c(A-)>c(HA) | |
| D. | 滴定过程中不可能出现c(Na+)>c(OH-)>c(A-)>c(H+) |
14.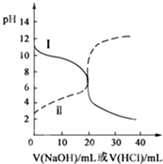 25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
 25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )| A. | 曲线Ⅰ:滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | 曲线Ⅰ:滴加溶液到20 mL时:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| C. | 曲线Ⅱ:滴加溶液在10 mL~20 mL之间时:c(NH4+)=c(Cl-)>c(OH-)=c(H+) | |
| D. | 曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
1.某研究性学习小组为了研究影响化学反应速率的因素,设计如下方案:
反应方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
(1)实验的记时方法是从溶液混合开始记时,至紫红色刚好褪去时,记时结束.
(2)实验①和②研究浓度对反应速率的影响,则V1=5.0mL,V2=3.0mL.
(3)下列有关该实验的叙述正确的是C、D.
A.实验时必须用移液管或滴定管来量取液体的体积
B.实验时应将5.0mLKMnO4溶液与5.0mL H2C2O4溶液混合后,立即按下秒表,再将盛有混合液的烧杯置于相应温度的水浴中至反应结束时,按下秒表,记录读数.
C.在同一温度下,最好采用平行多次实验,以确保实验数据的可靠性
D.实验①和③可研究温度对反应速率的影响
(4)某小组在进行每组实验时,均发现该反应是开始很慢,突然会加快,其可能的原因是反应生成的Mn2+对反应有催化作用.
| 实验 编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 反应温度/℃ | 反应时间/s |
| ① | 5.0mL | 5.0mL | 0 | 20 | 125 |
| ② | V1 | V2 | 2.0mL | 20 | 320 |
| ③ | 5.0mL | 5.0mL | 0 | 50 | 30 |
(1)实验的记时方法是从溶液混合开始记时,至紫红色刚好褪去时,记时结束.
(2)实验①和②研究浓度对反应速率的影响,则V1=5.0mL,V2=3.0mL.
(3)下列有关该实验的叙述正确的是C、D.
A.实验时必须用移液管或滴定管来量取液体的体积
B.实验时应将5.0mLKMnO4溶液与5.0mL H2C2O4溶液混合后,立即按下秒表,再将盛有混合液的烧杯置于相应温度的水浴中至反应结束时,按下秒表,记录读数.
C.在同一温度下,最好采用平行多次实验,以确保实验数据的可靠性
D.实验①和③可研究温度对反应速率的影响
(4)某小组在进行每组实验时,均发现该反应是开始很慢,突然会加快,其可能的原因是反应生成的Mn2+对反应有催化作用.
18.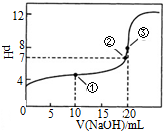 常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL0.1000mol•L-1CH3COOH溶液滴定曲线如图.下说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL0.1000mol•L-1CH3COOH溶液滴定曲线如图.下说法正确的是( )
 常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL0.1000mol•L-1CH3COOH溶液滴定曲线如图.下说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL0.1000mol•L-1CH3COOH溶液滴定曲线如图.下说法正确的是( )| A. | 点①所示溶液中:c(CH3COOH)+c(CH3COO-)>2c(Na+) | |
| B. | 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| C. | 点③所示溶液中:c(CH3COO-)>c(Na+) | |
| D. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
19.下列关于浓硫酸的叙述正确的是( )
| A. | 若浓硫酸不慎洒落在皮肤上应立即用干布拭去,再用大量水冲洗 | |
| B. | 可使蔗糖变黑,体现了浓硫酸的吸水性 | |
| C. | 常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓H2SO4不反应 | |
| D. | 可使胆矾变白,体现了浓硫酸的脱水性 |