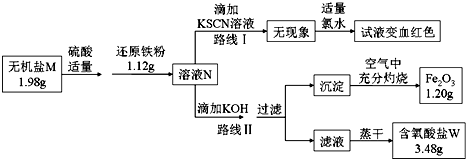
题目内容
12.某温度下,硫酸钡与水组成的混合物中,存在下列过程:BaSO4(s)?Ba2++SO42-,向其中加入少量硫酸钠固体,下列说法错误的是( )| A. | BaSO4的电离程度减小 | B. | BaSO4溶解的量减小 | ||
| C. | c(Ba2+)与c(SO42-)的乘积增大 | D. | 溶液的导电能力增强 |
分析 向其中加入少量硫酸钠固体,硫酸根离子浓度增大,平衡向着逆向移动,则硫酸钡的溶解度减小;硫酸钡为强电解质,在溶液中完全电离,则其电离程度不变;由于温度不变,则难溶物溶度积不变,故c(Ba2+)与c(SO42-)的乘积不变;溶液中离子浓度增大,溶液的导电性会增强,据此进行解答.
解答 解:A.硫酸钡在溶液中完全电离,则加入硫酸钠后,硫酸钡的电离程度不变,仍然为100%,故A错误;
B.加入硫酸钠后,溶液中硫酸根离子浓度增大,溶解平衡向着逆向移动,导致硫酸钡的溶解的量减小,故B正确;
C.c(Ba2+)与c(SO42-)的乘积为溶度积,由于温度不变,则硫酸钡的溶度积不变,故C错误;
D.加入硫酸钠后,溶液中离子浓度增大,则溶液的导电性增强,故D正确;
故选AC.
点评 本题考查了难溶物溶解平衡及其影响,题目难度中等,明确影响溶解平衡的因素为解答关键,注意溶度积只与难溶物性质、温度有关,为易错点,试题培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列叙述正确的是( )
| A. | 推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 用电解水的方法制取大量氢气可以缓解能源不足的问题 | |
| D. | 升高温度活化能降低 |
12.在铁制品上镀上一定厚度的锌层,以下设计方案正确的是( )
| A. | 锌作阳极,铁制品作阴极,溶液中含有锌离子 | |
| B. | 锌作阴极,铁制品作阳极,溶液中含有锌离子 | |
| C. | 锌作阳极,铁制品作阴极,溶液中含有亚铁离子 | |
| D. | 锌作阴极,铁制品作阳极,溶液中含有亚铁离子 |
17.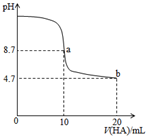 室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液,pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液,pH的变化曲线如图所示.下列说法正确的是( )
 室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液,pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液,pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | a、b两点所示溶液中水的电离程度相同 | |
| C. | b点所示溶液中c(A-)>c(HA) | |
| D. | 滴定过程中不可能出现c(Na+)>c(OH-)>c(A-)>c(H+) |
1.某研究性学习小组为了研究影响化学反应速率的因素,设计如下方案:
反应方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
(1)实验的记时方法是从溶液混合开始记时,至紫红色刚好褪去时,记时结束.
(2)实验①和②研究浓度对反应速率的影响,则V1=5.0mL,V2=3.0mL.
(3)下列有关该实验的叙述正确的是C、D.
A.实验时必须用移液管或滴定管来量取液体的体积
B.实验时应将5.0mLKMnO4溶液与5.0mL H2C2O4溶液混合后,立即按下秒表,再将盛有混合液的烧杯置于相应温度的水浴中至反应结束时,按下秒表,记录读数.
C.在同一温度下,最好采用平行多次实验,以确保实验数据的可靠性
D.实验①和③可研究温度对反应速率的影响
(4)某小组在进行每组实验时,均发现该反应是开始很慢,突然会加快,其可能的原因是反应生成的Mn2+对反应有催化作用.
| 实验 编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 反应温度/℃ | 反应时间/s |
| ① | 5.0mL | 5.0mL | 0 | 20 | 125 |
| ② | V1 | V2 | 2.0mL | 20 | 320 |
| ③ | 5.0mL | 5.0mL | 0 | 50 | 30 |
(1)实验的记时方法是从溶液混合开始记时,至紫红色刚好褪去时,记时结束.
(2)实验①和②研究浓度对反应速率的影响,则V1=5.0mL,V2=3.0mL.
(3)下列有关该实验的叙述正确的是C、D.
A.实验时必须用移液管或滴定管来量取液体的体积
B.实验时应将5.0mLKMnO4溶液与5.0mL H2C2O4溶液混合后,立即按下秒表,再将盛有混合液的烧杯置于相应温度的水浴中至反应结束时,按下秒表,记录读数.
C.在同一温度下,最好采用平行多次实验,以确保实验数据的可靠性
D.实验①和③可研究温度对反应速率的影响
(4)某小组在进行每组实验时,均发现该反应是开始很慢,突然会加快,其可能的原因是反应生成的Mn2+对反应有催化作用.
2.在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol•L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中正确的是( )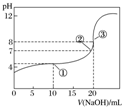

| A. | 该中和滴定过程,最宜用石蕊作指示剂 | |
| B. | 图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度 | |
| C. | 滴定过程中的某点,会有c(Na+)>c(CH3COO-)>c(H+)>c(OH-)的关系存在 | |
| D. | 图中点②所示溶液中,c(CH3COO-)=c(Na+) |