题目内容
7.某学习小组欲设计实验探究焦炭与二氧化硅反应的产物.查阅资料:实验室可以用PdCl2溶液检验CO,二者发生反应会产生黑色金属钯,溶液变浑浊.

回答下列问题:
(1)上述装置连接顺序(按气流从左至右)为B→D→A→C→E.
(2)加热前,向装置内通入一段时间氮气,其目的是要用氮气将装置中的空气排尽,避免空气中的氧气、二氧化碳、水蒸气对实验产生干扰;D装置的作用是作安全瓶,防止倒吸使玻璃管炸裂.
(3)若A中出现浑浊,写出A中发生反应的化学方程式PdCl2+CO+H2O=Pd+CO2+2HCl.
(4)C装置可用来检验CO2气体,可选用的试剂是B (填字母).
A.NaOH溶液 B.Ba(OH)2溶液 C.BaCl2溶液 D.品红溶液
(5)如果不用E装置,可能的后果是发生一氧化碳中毒.
(6)经测定B装置中生成的CO与CO2物质的量之比为2:1,写出B中发生反应的化学方程式2SiO2+3C$\frac{\underline{\;高温\;}}{\;}$2Si+2CO↑+CO2↑.
分析 (1)利用装置B发生碳和二氧化硅的反应,连接装置D起到防止倒吸的作用,生成的气体通过装置A检验CO的存在,若出现浑浊说明生成一氧化碳,通过装置C中的氢氧化钡或氢氧化钙检验是否生成二氧化碳气体,最后生育一气体不能排放到空气中,可以利用装置E收集;
(2)碳与二氧化硅反应要在高温下进行,而高温下碳与空气中氧气反应,所以实验时要将装置中的空气排尽;根据装置图可知,D装置可以作安全瓶,防止倒吸;
(3)实验室可以用PdCl2溶液检验CO,二者发生反应会产生黑色金属钯,溶液变浑浊,产生黑色金属钯粉末,使溶液变浑浊,结合原子守恒书写化学方程式;
(4)检验CO2气体需要通入发生反应出现明显的反应现象,可以用氢氧化钡溶液或氢氧化钙溶液;
(5)如果不用E装置,生成的气体中含有的一氧化碳有毒;
(6)根据元素守恒,经测定B装置中生成的CO与CO2物质的量之比为2:1,根据元素守恒可写出化学方程式.
解答 解:(1)利用装置B发生碳和二氧化硅的反应,连接装置D起到防止倒吸的作用,生成的气体通过装置A检验CO的存在,若出现浑浊说明生成一氧化碳,通过装置C中的氢氧化钡或氢氧化钙检验是否生成二氧化碳气体,最后生育一气体不能排放到空气中,可以利用装置E收集,上述装置连接顺序(按气流从左至右)为B→D→A→C→E,
故答案为:D→A→C;
(2)碳与二氧化硅反应要在高温下进行,而高温下碳与空气中氧气反应,所以实验时要将装置中的空气排尽,所以实验时要通人足够长时间的N2,根据装置图可知,B装置可以作安全瓶,防止倒吸,
故答案为:要用氮气将装置中的空气排尽,避免空气中的氧气、二氧化碳、水蒸气对实验产生干扰;作安全瓶,防止倒吸使玻璃管炸裂;
(2)除去装置内的空气,防止生成的一氧化碳与氧气反应,发生爆炸;防止倒吸,使玻璃管炸裂;
(3)若A中出现浑浊,一氧化碳和氯化钯溶液二者发生反应会产生黑色金属钯,溶液变浑浊,产生黑色金属钯粉末,使溶液变浑浊,同时生成二氧化碳和盐酸,A中发生反应的化学方程式为:PdCl2+CO+H2O=Pd+CO2+2HCl,
故答案为:PdCl2+CO+H2O=Pd+CO2+2HCl;
(4)C装置可用来检验CO2气体,选项中,
A.二氧化碳和氢氧化钠溶液反应无现象,故A不选;
B.Ba(OH)2溶液和二氧化碳反应生成碳酸钡沉淀,溶液出现浑浊,可以检验二氧化碳的存在,故b选;
C.二氧化碳气体和BaCl2溶液不反应,故C不选;
D.二氧化碳通入品红溶液无现象,故D不选;
故答案为:B;
(5)如果不用E装置,生成的气体中含有的一氧化碳有毒,直接排放到空气中会发生一氧化碳中毒,
故答案为:发生一氧化碳中毒;
(6)经测定B装置中生成的CO与CO2物质的量之比为2:1,结合原子守恒配平书写得到化学方程式为:2SiO2+3C$\frac{\underline{\;高温\;}}{\;}$2Si+2CO↑+CO2↑,
故答案为:2SiO2+3C$\frac{\underline{\;高温\;}}{\;}$2Si+2CO↑+CO2↑.
点评 本题考查了反应产物的实验验证,主要是物质性质的理解应用,反应现象和产物的确定方法是解题关键,掌握基础和实验过程是解题关键,题目难度中等.

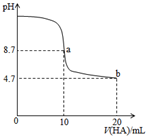 室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液,pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液,pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | a、b两点所示溶液中水的电离程度相同 | |
| C. | b点所示溶液中c(A-)>c(HA) | |
| D. | 滴定过程中不可能出现c(Na+)>c(OH-)>c(A-)>c(H+) |
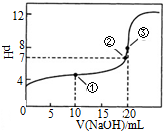 常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL0.1000mol•L-1CH3COOH溶液滴定曲线如图.下说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL0.1000mol•L-1CH3COOH溶液滴定曲线如图.下说法正确的是( )| A. | 点①所示溶液中:c(CH3COOH)+c(CH3COO-)>2c(Na+) | |
| B. | 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| C. | 点③所示溶液中:c(CH3COO-)>c(Na+) | |
| D. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
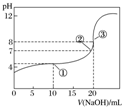
| A. | 该中和滴定过程,最宜用石蕊作指示剂 | |
| B. | 图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度 | |
| C. | 滴定过程中的某点,会有c(Na+)>c(CH3COO-)>c(H+)>c(OH-)的关系存在 | |
| D. | 图中点②所示溶液中,c(CH3COO-)=c(Na+) |
| A. | 若浓硫酸不慎洒落在皮肤上应立即用干布拭去,再用大量水冲洗 | |
| B. | 可使蔗糖变黑,体现了浓硫酸的吸水性 | |
| C. | 常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓H2SO4不反应 | |
| D. | 可使胆矾变白,体现了浓硫酸的脱水性 |
| 步骤 | 操作 | 现象 |
| (1) | 取少量溶液滴加几滴石蕊试液 | 溶液变蓝 |
| (2) | 另取少量溶液滴加过量氯水,再加入CCl4振荡,静置 | 上层无色,下层呈紫色 |
| (3) | 取(2)上层溶液,加入过量Ba(NO3)2溶液和稀HNO3,过滤 | 有白色沉淀产生 |
| (4) | 向(3)的滤液中加入过量AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A. | 可能含有 Cl-、SO32-、SO42- | B. | 肯定没有 Ba2 +、Cl-、I- | ||
| C. | 不能确定 Na+、SO32-、SO42- | D. | 肯定含有 Na+、I-、SO32- |
| A. | a<7时,水的电离受到抑制 | B. | a>7时,水的电离受到抑制 | ||
| C. | a<7时,溶液的pH一定为a | D. | a>7时,溶液的pH一定为14-a |
 已知25℃时,0.10mol.L-1的CH3COOH的电离度为1.3%,pH=3.1.
已知25℃时,0.10mol.L-1的CH3COOH的电离度为1.3%,pH=3.1.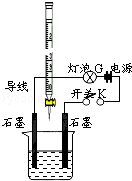 有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.常温下,水的离子积Kw=1×10-14.
有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.常温下,水的离子积Kw=1×10-14.