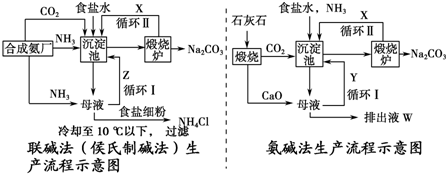
题目内容
17.用石墨作电极电解CuSO4溶液,通电一段时间后,加入0.3mol的氢氧化铜恰好使电解后溶液复原,则在电解过程中阴极生成H2的物质的量为( )| A. | 0.15 mol | B. | 0.3 mol | C. | 0.45 mol | D. | 0.6mol |
分析 根据电解池的工作原理,要想让电解后的电解质复原,则遵循的原则是:出什么加什么,加入 Cu(OH)2后溶液与电解前相同,Cu(OH)2从组成上可看成CuO•H2O,所以实际上相当于加入的物质是氧化铜和水,阴极上析出氢气和铜,据此分析.
解答 解:加入0.3 mol Cu(OH)2后恰好恢复到电解前的浓度和pH,Cu(OH)2从组成上可看成CuO•H2O,根据“析出什么加入什么”的原则知,析出的物质是氧化铜和水,则阴极上析出氢气和铜,根据原子守恒知,消耗0.3mol水则放出0.3mol氢气,所以阴极生成H2的物质的量为0.3mol;故选B.
点评 本题考查了电解原理,明确阴极上析出的物质是解本题关键,根据出什么加什么来解答即可,难度中等.

练习册系列答案
相关题目
8.将m g含氧化铁、氧化铜或氧化亚铁的样品投入到2L物质的量浓度为1mol/L的盐酸中恰好完全反应,若向等质量的该样品中通入足量的氢气并加热,充分反应后所得金属的质量是( )
| A. | (m-16)g | B. | (m+16)g | C. | (m-32)g | D. | 16g |
5.下列反应可能属于吸热反应的是( )
| A. | 甲烷与氧气反应 | B. | 碳酸钙分解反应 | C. | KOH与稀硫酸反应 | D. | 铁丝与氯气反应 |
12.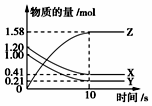 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )| A. | 反应开始到10 s,用Z表示的反应速率为0.079mol•(L•s)-1 | |
| B. | 反应开始到10 s,X的物质的量浓度减少了0.79mol•L-1 | |
| C. | 该反应不是可逆反应 | |
| D. | 反应的化学方程式为X(g)+Y(g)?Z(g) |
2.下列离子或分子在溶液中能大量共存且满足相应要求的是( )
| 选项 | 离子或分子 | 要 求 |
| A | K+、SO42-、Cl-、HS- | c(K+)<c(SO42-) |
| B | Fe3+、Na+、NO3-、ClO- | 溶液pH=1 |
| C | Na+、Al3+、Cl-、SO42- | 滴加氨水立即有沉淀产生 |
| D | NH4+、Ba2+、NO3-、CH3COOH | 滴加NaOH溶液立即有气泡产生 |
| A. | A | B. | B | C. | C | D. | D |
6.在一密闭容器中充入1mol H2和1mol I2,压强为p(Pa),在一定温度下反应:H2(g)+I2(g)?2HI(g)△H<0,平衡后改变条件,下列叙述正确的是( )
| A. | 保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应速率加快 | |
| B. | 提高起始的反应温度,正反应速率加快,逆反应速率减慢,平衡正向移动 | |
| C. | 保持容器内气体压强不变,向其中加入1 mol Ne,反应速率加快,平衡正向移动 | |
| D. | 保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),反应速率不变 |