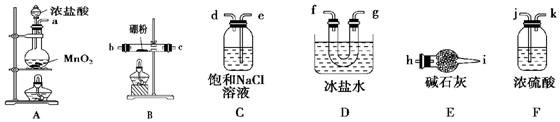
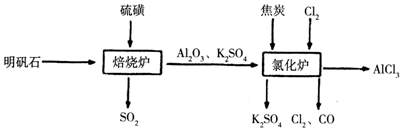
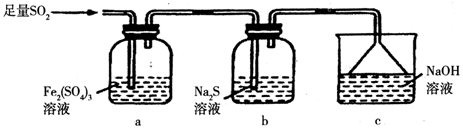
题目内容
5.下列反应可能属于吸热反应的是( )| A. | 甲烷与氧气反应 | B. | 碳酸钙分解反应 | C. | KOH与稀硫酸反应 | D. | 铁丝与氯气反应 |
分析 根据常见的放热反应有:所有的物质燃烧、金属与酸或水反应、中和反应、铝热反应、绝大多数化合反应等;常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),八水合氢氧化钡与氯化铵的反应,以此解答该题.
解答 解:A.甲烷为清洁燃料,燃烧放出热量,为放热反应,故A错误;
B.碳酸钙分解吸收能量,故B正确;
C.中和反应为放热反应,故C错误;
D.活泼金属与氯气的反应为放热反应,铁在氯气中可燃烧,故D错误.
故选B.
点评 本题考查化学反应的热量变化,为高频考点,学生应注重归纳中学化学中常见的吸热或放热的反应,对于特殊过程中的热量变化的要熟练记忆来解答此类习题,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.工业上用DME法以H2和CO为原料生产甲醚(CH3OCH3).其原理是在同一容器中发生如下两个连续反应:
①2H2(g)+CO(g)═CH3OH(g)
②2CH3OH(g)═CH3OCH3(g)+H2O(g)
当达到平衡时实验数据如表,下列分析正确的是( )
①2H2(g)+CO(g)═CH3OH(g)
②2CH3OH(g)═CH3OCH3(g)+H2O(g)
当达到平衡时实验数据如表,下列分析正确的是( )
| 温度(℃) 平衡态 | 260 | 270 | 280 | 290 | 300 | 310 | 320 |
| CO转化率(%) | 92 | 87 | 82 | 80 | 72 | 65 | 62 |
| CH3OCH3产率(%) | 33 | 45 | 77 | 79 | 62 | 58 | 52 |
| A. | 反应①、②均为吸热反应 | |
| B. | 290℃时反应②平衡常数值达到最大 | |
| C. | 平衡时,反应①与②中CH3OH的消耗速率一定相等 | |
| D. | 增大压强能增大CH3OCH3产率 |
16.下列措施能明显增大原反应的化学反应速率的是( )
| A. | 恒温恒容条件下,在工业合成氨反应中,增加氮气的量 | |
| B. | 将稀硫酸改为98%的浓硫酸与Zn反应制取H2 | |
| C. | 在H2SO4与NaOH两溶液反应时,增大压强 | |
| D. | Na与水反应时增大水的用量 |
13.下列离子方程式的书写正确的是( )
| A. | 水玻璃中通入过量二氧化硫:Na2SiO3+SO2+H2O═2Na++SO32-+H2SiO3↓ | |
| B. | 铁屑溶于过量稀硝酸:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| C. | 往碳酸钙中滴加稀盐酸:CO32-+2H+═H2O+CO2↑ | |
| D. | 在NaOH溶液中加入少量Ca(HCO3)2溶液:Ca2++2HCO3-+2OH -═CaCO3↓+CO32-+2H2O |
17.用石墨作电极电解CuSO4溶液,通电一段时间后,加入0.3mol的氢氧化铜恰好使电解后溶液复原,则在电解过程中阴极生成H2的物质的量为( )
| A. | 0.15 mol | B. | 0.3 mol | C. | 0.45 mol | D. | 0.6mol |
14.下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A. | 酸性氧化物 干冰 CO2 | B. | 碱 纯碱 Na2CO3 | ||
| C. | 酸 硫酸 H2SO3 | D. | 单质 氯水 Cl2 |
20.(1)在一密闭容器中一定量A、B的混合气体发生反应:aA(g)+bB(g)?cC(s)+dD(g),
平衡时测得A的浓度为0.60mol/L,保持温度不变,将容器的容积扩大到原来的3倍,再达平衡时,测得A的浓度降为0.20mol/L.下列有关判断一定正确的是D
A.平衡向正反应方向移动
B.A的转化率增大
C.D的体积分数增大
D.a+b<c+d
(2)①25℃,两种酸的电离平衡常数如表.
HSO3-的电离平衡常数表达式K=$\frac{c({H}^{+})•c(S{{O}_{3}}^{2}{\;}^{-})}{c(HS{O}_{3}{\;}^{-})}$.
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
③根据H2SO3的电离常数数据,判断NaHSO3溶液显酸性还是显碱性?
平衡时测得A的浓度为0.60mol/L,保持温度不变,将容器的容积扩大到原来的3倍,再达平衡时,测得A的浓度降为0.20mol/L.下列有关判断一定正确的是D
A.平衡向正反应方向移动
B.A的转化率增大
C.D的体积分数增大
D.a+b<c+d
(2)①25℃,两种酸的电离平衡常数如表.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
③根据H2SO3的电离常数数据,判断NaHSO3溶液显酸性还是显碱性?