题目内容
7.如图是联合制碱法(侯氏制碱法)和氨碱法的流程示意图.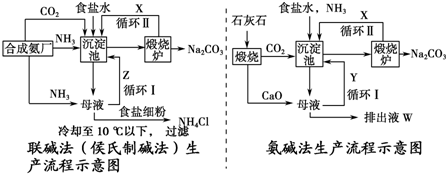
(1)沉淀池中涉及的总反应的离子方程式是:NH3+CO2+H2O+Na++Cl-=NaHCO3↓+NH4++Cl-.此时溶液中相当于有4种离子型产物大量存在,进入煅烧炉的物质是NaHCO3.写出煅烧的化学方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O↑+CO2↑.
(2)X是CO2,Y是NH3(填化学式).
(3)某实验小组在实验室模拟主要反应过程,向100mL锥形瓶中一次性加入25mL浓氨水,10mL蒸馏水,以及10.0g粉状NaCl,振荡使NaCl溶解并达到饱和,向其中通入CO2.
实验小组发现实验过程中CO2的通入量过大、过小都不好,都会使产物的产率降低,原因是过大,未反应的CO2逸出带出氨气,原料气的损耗导致NaHCO3产率下降过小,生成的NH4HCO3不足,导致NaHCO3产率下降.
对此实验小组作了改进.将氨水分三次加入,第一次加入氨水后,滴入1~2滴酚酞,然后通入CO2,随着CO2的通入,溶液颜色的变化为溶液颜色由红变无色,此时再加入氨水,重复此操作.此改进的好处是分次加入可以减少氨的逸出,同时酚酞变色指示加入氨水的时机,可以充分利用CO2.
分析 联碱法是以食盐、氨和二氧化碳(其中二氧化碳来自合成氨厂用水煤气制取氢气时的废气)为原料来制取纯碱,联合制碱法是向饱和的氯化钠溶液中,先通入氨气后通入过量的二氧化碳,根据溶解度之间的差异得到碳酸氢钠沉淀,碳酸氢钠灼烧分解得到碳酸钠;其滤液是含有氯化铵和氯化钠的溶液,第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体,在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品,纯碱工厂与合成氨工厂进行联合生产,以便获得原料NH3、CO2,联合制碱法循环物质:氯化钠,二氧化碳,而在氨碱法中循环使用率不高,根据物质的性质来回答.
解答 解:(1)联碱法是以食盐、氨和二氧化碳(其中二氧化碳来自合成氨厂用水煤气制取氢气时的废气)为原料来制取纯碱,联合制碱法是向饱和的氯化钠溶液中,先通入氨气后通入过量的二氧化碳,根据溶解度之间的差异得到碳酸氢钠沉淀,碳酸氢钠灼烧分解得到碳酸钠,沉淀池中涉及的总反应的离子方程式是:NH3+CO2+H2O+Na++Cl-=NaHCO3↓+NH4++Cl-;NaHCO3;2 NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O↑+CO2↑,故答案为:NH3+CO2+H2O+Na++Cl-=NaHCO3↓+NH4++Cl-;NaHCO3;2 NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O↑+CO2↑;
(2)从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体,在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品,纯碱工厂与合成氨工厂进行联合生产,以便获得原料NH3、CO2,联合制碱法循环物质:氯化钠,二氧化碳,X是CO2,Y是NH3;故答案为:CO2,NH3;
(3)NaCl溶解并达到饱和的溶液中通入CO2,实验过程中CO2的通入量过大、过小都不好,过大,未反应的CO2逸出带出氨气,原料气的损耗导致NaHCO3产率下降、过小,生成的NH4HCO3不足,导致NaHCO3产率下降;一次加入氨水后,滴入1~2滴酚酞,然后通入CO2,随着CO2的通入,溶液从碱性碳酸铵转化为弱酸性的碳酸氢铵,颜色的变化为溶液颜色由红变无色;分次加入可以减少氨的逸出,同时酚酞变色指示加入氨水的时机,可以充分利用CO2.
故答案为:过大,未反应的CO2逸出带出氨气,原料气的损耗导致NaHCO3产率下降、过小,生成的NH4HCO3不足,导致NaHCO3产率下降;溶液颜色由红变无色;分次加入可以减少氨的逸出,同时酚酞变色指示加入氨水的时机,可以充分利用CO2.
点评 本题主要考查了联合制碱法(侯氏)的原理,掌握工艺流程和反应原理是解题关键,题目难度不大.

| A. | 胶体的分散质粒子直径在1nm~100nm之间 | |
| B. | 胶体粒子带电荷并且在一定条件下能稳定存在 | |
| C. | 胶体粒子不能穿过半透膜,能通过滤纸空隙 | |
| D. | 光束通过胶体时有丁达尔效应 |
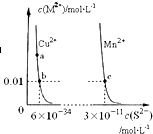
| A. | a点对应的 Ksp大于b点对应的Ksp | |
| B. | 向CuSO4溶液中加入MnS发生如下反应:Cu2+(aq)+MnS(s)═CuS(s)+Mn2+(aq) | |
| C. | 在含有CuS和MnS固体的溶液中c(Cu2+):c(Mn2+)=2×10-23:1 | |
| D. | 该温度下,Ksp(CuS)小于Ksp(MnS) |
①2H2(g)+CO(g)═CH3OH(g)
②2CH3OH(g)═CH3OCH3(g)+H2O(g)
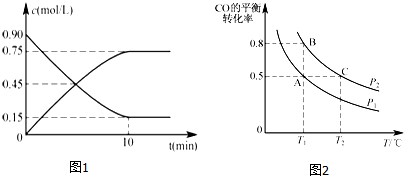
当达到平衡时实验数据如表,下列分析正确的是( )
| 温度(℃) 平衡态 | 260 | 270 | 280 | 290 | 300 | 310 | 320 |
| CO转化率(%) | 92 | 87 | 82 | 80 | 72 | 65 | 62 |
| CH3OCH3产率(%) | 33 | 45 | 77 | 79 | 62 | 58 | 52 |
| A. | 反应①、②均为吸热反应 | |
| B. | 290℃时反应②平衡常数值达到最大 | |
| C. | 平衡时,反应①与②中CH3OH的消耗速率一定相等 | |
| D. | 增大压强能增大CH3OCH3产率 |
 已知三个反应如下:
已知三个反应如下:Fe(s)+H2O(g)?FeO(s)+H2(g)△H1平衡常数为K1;
CO(g)+H2O(g)?H2(s)+CO2(g)△H2平衡常数为K2;
Fe(s)+CO2(g)?FeO(s)+CO(g)△H3平衡常数为K3;
在不同温度下,部分K1、K2的值如下:
| T/℃ | 700℃ | 800℃ |
| K1 | 2.38 | 2.56 |
| K2 | 0.80 |
(2)要使反应I在一定条件下建立的平衡右移,可采取的措施有CE.(填字母)
A.缩小容器体积 B.降低温度 C.升高温度
D.使用合适的催化剂 E.设法减少H2的量 F.设法减少Fe0的量
(3)已知反应II在800℃可以自发进行,则△H2>0(填“>”、“<”或“=”),由以上信息推断反应III正反应方向为放热反应.(填“吸热”或“放热”)
(4)800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应II,反应在第6min时达到平衡,反应过程中测定的部分数据见表:
| 反应时间/min | 0 | 2 | 4 | 6 |
| N(CO)/mol | 1.20 | 0.90 | 0.80 | |
| N(H2O)/mol | 0.60 | 0.20 |
②800℃时,K2的值为1;
③若反应进行到某一时刻时,混合物中各组分的浓度分别为:c(CO)=0.002mol/L,
c(H2O)=0.003mol/L,c(CO2)=0.0025mol/L,c(H2)=0.0025moUL,则此时反应II中v(正)<v(逆).(填“>”、“<”或“=”)
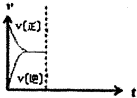
(5)在恒温恒压密闭容器中通入CO和H2O各1mol发生反应II,当反应达到平衡后,维持温度与压强不变,t1时再通入各l mol的CO和H2O的混合气体,请在图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图.
| A. | 恒温恒容条件下,在工业合成氨反应中,增加氮气的量 | |
| B. | 将稀硫酸改为98%的浓硫酸与Zn反应制取H2 | |
| C. | 在H2SO4与NaOH两溶液反应时,增大压强 | |
| D. | Na与水反应时增大水的用量 |
| A. | 0.15 mol | B. | 0.3 mol | C. | 0.45 mol | D. | 0.6mol |
 甲醇是一种重要的可再生能源.
甲醇是一种重要的可再生能源.