题目内容
9.化学工业生产上容易产生工业“三废”,'变废为宝,探索利用是化学必需要完成的.某工厂的工此废料中含有铜、铝、铁,可利用其制备CuSO4•5H2O、Fe SO4•7H2O和AlCl3过程如图:
(1)将AlCl3溶液蒸干并灼烧,得到的产物是Al2O3.
(2)写出A→C的化学方程式:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3.
(3)检验滤液D中的金属阳离子的方法:取少量D溶液于试管中,滴加KSCN溶液,无现象,再滴加新制氯水,溶液变成血红色,有Fe2+存在.
(4)写出E→CuSO4的化学方程式:2Cu+2H2SO4+O2=2CuSO4+2H2O.
(5)写出废料与烧碱反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)取少量滤液D,向其中加入双氧水,现象为:溶液变为黄色.
(7)用CuSO4溶液作粗铜的精炼液,阴极上发生的电极反应式为:Cu2++2e-=Cu.
(8)钠和铝都是活泼金属,写出工此生产钠的化学方程式:2NaCl$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑.
分析 含有铝、铁、铜的合金加入氢氧化钠溶解,只有铝与氢氧化钠反应生成偏铝酸钠和氢气,所以滤渣B为铁和铜,再经稀硫酸反应过滤的滤液为氯化亚铁,进一步转化成绿矾,滤渣F为铜单质,进一步转化成胆矾;滤液A则为偏铝酸钠溶液,加过量盐酸经途径Ⅰ生成氯化铝溶液,而滤液A通足量气体C经途径Ⅱ生成沉淀D,根据氢氧化铝只溶于强酸强碱,所以气体C为二氧化碳,沉淀D为氢氧化铝,与盐酸反应生成氯化铝溶液,
(1)铝离子水解生成氢氧化铝和氢离子,溶液显示酸性,氢氧化铝受热分解生成氧化铝和水.
(2)A→C的反应就是偏铝酸钠溶液中通入过量的二氧化碳的反应;
(3)滤液D为氯化亚铁溶液,检验Fe2+的试剂是KSCN溶液和新制氯水;
(4)滤渣F为铜单质,转化成胆矾的方法是在滤渣F中加入硫酸再通入热空气反应成CuSO4溶液;
(5)废料中有Al,Al为两性元素;
(6)滤液D为氯化亚铁溶液,加入双氧水将把Fe2+氧化为Fe3+;
(7)用CuSO4溶液作粗铜的精炼液,阴极上发生的电极反应式为还原反应;
(8)钠是活泼金属,工业上生产钠是用电解熔融的NaCl可得Na.
解答 解:(1)氯化铝溶液中,铝离子水解生成氢氧化铝和氢离子,导致溶液显示酸性,实质是:Al3++3H2O?Al(OH)3+3H+,把AlCl3溶液蒸干灼烧,水解平衡向右移动,生成氢氧化铝,同时盐酸挥发,最后得到的主要固体产物是氢氧化铝,受热分解生成氧化铝和水,
故答案为:Al2O3;
(2)偏铝酸钠溶液中通入过量的二氧化碳的反应:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;
故答案为:NaAlO2+CO2+2H2O=Al (OH)3↓+NaHCO3;
(3)滤液D为氯化亚铁溶液,检验Fe2+的方法是:取少量D溶液于试管中,滴加KSCN溶液,无现象,再滴加新制氯水,溶液变成血红色,有Fe 2+存在.
故答案为:取少量D溶液于试管中,滴加KSCN溶液,无现象,再滴加新制氯水,溶液变成血红色,有Fe 2+存在;
(4)滤渣F为铜单质,转化成胆矾的方法是在滤渣F中加入硫酸再通入热空气反应成CuSO4溶液,化学方程式为2Cu+2 H2SO4+O2=2CuSO4+2 H2O;
故答案为:2Cu+2 H2SO4+O2=2CuSO4+2 H2O;
(5)废料中有Al,Al为两性元素,Al溶于NaOH溶液的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(6)滤液D为氯化亚铁溶液,加入双氧水将把Fe2+氧化为Fe3+,故溶液由浅绿色变为黄色,
故答案为:溶液变为黄色;
(7)用CuSO4溶液作粗铜的精炼液,阴极上发生的电极反应式为还原反应,Cu2++2e-=Cu,
故答案为:Cu2++2e-=Cu;
(8)工业上生产钠是用电解熔融的NaCl可得Na:2NaCl$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑,
故答案为:2NaCl$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑.
点评 本题主要考查了从工业废料中制取纯净物,注意从框图转化中找出有用信息,利用有关的化学反应进行解答,难度中等.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案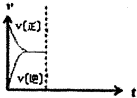 已知三个反应如下:
已知三个反应如下:Fe(s)+H2O(g)?FeO(s)+H2(g)△H1平衡常数为K1;
CO(g)+H2O(g)?H2(s)+CO2(g)△H2平衡常数为K2;
Fe(s)+CO2(g)?FeO(s)+CO(g)△H3平衡常数为K3;
在不同温度下,部分K1、K2的值如下:
| T/℃ | 700℃ | 800℃ |
| K1 | 2.38 | 2.56 |
| K2 | 0.80 |
(2)要使反应I在一定条件下建立的平衡右移,可采取的措施有CE.(填字母)
A.缩小容器体积 B.降低温度 C.升高温度
D.使用合适的催化剂 E.设法减少H2的量 F.设法减少Fe0的量
(3)已知反应II在800℃可以自发进行,则△H2>0(填“>”、“<”或“=”),由以上信息推断反应III正反应方向为放热反应.(填“吸热”或“放热”)
(4)800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应II,反应在第6min时达到平衡,反应过程中测定的部分数据见表:
| 反应时间/min | 0 | 2 | 4 | 6 |
| N(CO)/mol | 1.20 | 0.90 | 0.80 | |
| N(H2O)/mol | 0.60 | 0.20 |
②800℃时,K2的值为1;
③若反应进行到某一时刻时,混合物中各组分的浓度分别为:c(CO)=0.002mol/L,
c(H2O)=0.003mol/L,c(CO2)=0.0025mol/L,c(H2)=0.0025moUL,则此时反应II中v(正)<v(逆).(填“>”、“<”或“=”)
(5)在恒温恒压密闭容器中通入CO和H2O各1mol发生反应II,当反应达到平衡后,维持温度与压强不变,t1时再通入各l mol的CO和H2O的混合气体,请在图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图.
| A. | 0.15 mol | B. | 0.3 mol | C. | 0.45 mol | D. | 0.6mol |
| A. | 400mL | B. | 500mL | C. | 450mL | D. | 无法确定 |
| A. | 酸性氧化物 干冰 CO2 | B. | 碱 纯碱 Na2CO3 | ||
| C. | 酸 硫酸 H2SO3 | D. | 单质 氯水 Cl2 |
| 选项 | A | B | C | D |
| 第一次加入 | Al | Na | Zn | Mg |
| 第二次加入 | K | Mg | Al | Cu |
| A. | A | B. | B | C. | C | D. | D |
| 化学式 | 颜色 | Ksp |
| AgCl | 白色 | 2.0×10-10 |
| AgBr | 浅黄色 | 5.4×10-13 |
| AgI | 黄色 | 8.3×10-17 |
| Ag2S | 黑色 | 2.0×10-48 |
| Ag2CrO4 | 红色 | 2.0×10-12 |
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=2.7×10-3.
(3)测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是D.
A.KBr B.KI C.K2S D.K2CrO4.
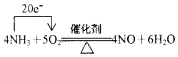 .若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为$\frac{22.4n}{5V}$(写出含字母的表达式).
.若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为$\frac{22.4n}{5V}$(写出含字母的表达式).