��Ŀ����
12������̼�Ļ���������������������������أ���1�����Ȱ���NH2Cl����������������Һ�ȴ�������ˮ��ͬʱͨ������������������Ӧ��Cl2+NH3�TNH2Cl+HCl�����ɵ�NH2Cl�ܲ���ˮ������ǿ�����Ե����ʣ�������ɱ�������ã�
���Ȱ�����������ɱ����ԭ����NH2Cl+H2O?NH3+HClO���û�ѧ����ʽ��ʾ����
�ھ��Ȱ��������������ˮ�У���Ԫ�ض���NH4+ ����ʽ���ڣ���֪��
NH4+��aq��+1.5O2��g���TNO2-��aq��+2H+��aq��+H2O ��l��+273kJ
NH4+��aq��+2O2��g���TNO3-��aq��+2H+��aq��+H2O ��l��+346kJ
NO2-��aq����O2������NO3-��aq�����Ȼ�ѧ����ʽΪ2NO2-��aq��+O2��g���T2NO3-��aq����H=-146kJ•mol-1��
��2�����õ��ԭ���ɽ�NO��ԭΪN2��װ�ü�ͼ1�������ӵ����Ե�SCY�մɣ��ܴ���H+��Ϊ���ʣ������ٱ�Ĥ���缫��

�ٵ缫AΪ�������缫��ӦʽΪ2NO+4H++4e-=N2 +2H2O��
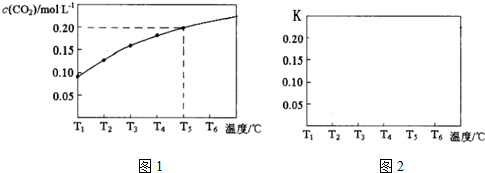
��3��һ����̼�ɽ����������ﻹԭΪ�������ʺͶ�����̼�����ֽ��������Cr2O3��SnO2��PbO2��Cu2O����һ����̼��ԭʱ��lgc��CO2��c��CO�����¶ȣ�t���Ĺ�ϵ����ͼ��ͼ2��
��700��ʱ���������ѱ���ԭ�Ľ�����������Cr2O3���ѧʽ����
��700��һ����̼��ԭ���н���������ķ�Ӧ����ʽϵ��Ϊ��������ȣ��÷�Ӧ��ƽ�ⳣ����K����ֵ����10-12��
��4��һ����̼���Խ�����ת��Ϊ���ȴ�99.9%�ĸߴ�������Ӧԭ���ǣ�
Ni��s��+4CO��g��$?_{10-30��}^{50-80��}$Ni��CO��4��g����������������ȷ����C��������ţ�
A������Ӧ�ġ�S��0����H��0 B�����¡���ѹ�����ڸߴ��������� C���ù�����CO����ѭ�����ã�
���� ��1����NH2Cl�ܲ���ˮ������HClO�Ͱ��������������ǿ�������ԣ�
�ڢ�NH4+��aq��+1.5O2��g���TNO2-��aq��+2H+��aq��+H2O��l����H=-273kJ•mol-1
��NH4+��aq��+2O2��g���TNO3-��aq��+2H+��aq��+H2O��l����H=-346kJ•mol-1��
�ڡ�2-�١�2�ã�2NO2-��aq��+O2��g���T2NO3-��aq�������ݸ�˹���ɼ��㷴Ӧ�ȣ���д�Ȼ�ѧ����ʽ��
��2���������ٵ缫A�ķ�Ӧ����������֪������ԭ��Ӧ�������غ���ƽ���õ缫��Ӧʽ��
��3��700��ʱ��KԽС��˵����Ӧ���еij̶�С������������Խ�ѱ���ԭ����Cr2O3��Ӧ��lg$\frac{c��CO��}{c��C{O}_{2}��}$��$\frac{c��C{O}_{2}��}{c��co��}$�����Cr2O3��CO��Ӧ�Ļ�ѧ����ʽ�ɵ�K��
��4���ɷ�Ӧ������֪������������������Ӧ���У��������������淴Ӧ���У������¶�ƽ�������ȷ�Ӧ�ƶ����ݴ��жϣ�
��� �⣺��1����NH2Cl�ܲ���ˮ������HClO�Ͱ�������������ɱ�������ã�����ʽΪNH2Cl+H2O?NH3+HClO��
�ʴ�Ϊ��NH2Cl+H2O?NH3+HClO��
�ڢ�NH4+��aq��+1.5O2��g���TNO2-��aq��+2H+��aq��+H2O��l����H=-273kJ•mol-1
��NH4+��aq��+2O2��g���TNO3-��aq��+2H+��aq��+H2O��l����H=-346kJ•mol-1��
�ڡ�2-�١�2�ã�2NO2-��aq��+O2��g���T2NO3-��aq�������ݸ�˹���ɣ���H=2����-346kJ•mol-1��+2��273kJ•mol-1=-146kJ•mol-1��
�Ȼ�ѧ����ʽ��2NO2-��aq��+O2��g���T2NO3-��aq����H=-146kJ•mol-1��
��2�����ٵ缫A��NO ת��ΪN2 ��������ԭ��Ӧ����Ϊ������������֪��Ӧ�������������غ���ƽ���õ缫��ӦʽΪ2NO+4H++4e-=N2 +2H2O��
�ʴ�Ϊ������ 2NO+4H++4e-=N2 +2H2O
��3��700��ʱ��lg$\frac{c��CO��}{c��C{O}_{2}��}$Խ����KԽС��˵����Ӧ���еij̶�С������������Խ�ѱ���ԭ����ʱCr2O3��Ӧ��lg$\frac{c��CO��}{c��C{O}_{2}��}$=4����$\frac{c��C{O}_{2}��}{c��CO��}$=10-4�����Cr2O3��CO��Ӧ�Ļ�ѧ����ʽCr2O3+3CO$\frac{\underline{\;\;��\;\;}}{\;}$2Cr+3CO2���ɵ�K=[$\frac{c��C{O}_{2}��}{c��CO��}$]3=10-12��
�ʴ�Ϊ��Cr2O3��10-12��
��4���ɷ�Ӧ������֪������������������Ӧ���У��������������淴Ӧ���У������¶�ƽ������ȷ�Ӧ�ƶ���
A���ɷ�Ӧ������֪������������������Ӧ���У��������������淴Ӧ���У������¶�ƽ�������ȷ�Ӧ�ƶ����ʸ÷�Ӧ����ӦΪ���ȷ�Ӧ������H��0����A����
B������ӦΪ���ȷ�Ӧ�����������¶�ƽ���������ƶ����������ڸߴ��������ɣ���B����
C����������CO����������CO������CO����ѭ��ʹ�ã���C��ȷ��
��ѡ��C��
���� ���⿼���˻�ѧƽ��Ӱ�����ء���ѧƽ��ͼ��ѧƽ�ⳣ������ѧ����ʽ����д���Ȼ�ѧ����ʽ����д���缫��Ӧʽ����д�ȣ���Ŀ�ۺ���ǿ���ѶȽϴ�

| A�� | 0.15 mol | B�� | 0.3 mol | C�� | 0.45 mol | D�� | 0.6mol |
| ѡ�� | A | B | C | D |
| ��һ�μ��� | Al | Na | Zn | Mg |
| �ڶ��μ��� | K | Mg | Al | Cu |
| A�� | A | B�� | B | C�� | C | D�� | D |
ƽ��ʱ���A��Ũ��Ϊ0.60mol/L�������¶Ȳ��䣬���������ݻ�����ԭ����3�����ٴ�ƽ��ʱ�����A��Ũ�Ƚ�Ϊ0.20mol/L�������й��ж�һ����ȷ����D
A��ƽ��������Ӧ�����ƶ�
B��A��ת��������
C��D�������������
D��a+b��c+d
��2����25�棬������ĵ���ƽ�ⳣ�������
| Ka1 | Ka2 | |
| H2SO3 | 1.3��10-2 | 6.3��10-8 |
| H2CO3 | 4.2��10-7 | 5.6��10-11 |
��H2SO3��Һ��NaHCO3��Һ��Ӧ����Ҫ���ӷ���ʽΪH2SO3+HCO3-=HSO3-+CO2��+H2O��
�۸���H2SO3�ĵ��볣�����ݣ��ж�NaHSO3��Һ�����Ի����Լ��ԣ�
| A�� | ��101 kPaʱ��1 mol������ȫȼ��ʱ���ų������������������ʵ�ȼ���� | |
| B�� | ��ͼ���кͷ�Ӧ����1 molˮ����ʱ�ķ�Ӧ�Ƚ��к��� | |
| C�� | ȼ���Ⱥ��к����Ƿ�Ӧ�ȵ�����֮һ | |
| D�� | ��ϡ��Һ�У�1 mol�����1 mol����������ȫ�к�ʱ�ų�������Ϊ57.3 kJ |
| ��ѧʽ | ��ɫ | Ksp |
| AgCl | ��ɫ | 2.0��10-10 |
| AgBr | dz��ɫ | 5.4��10-13 |
| AgI | ��ɫ | 8.3��10-17 |
| Ag2S | ��ɫ | 2.0��10-48 |
| Ag2CrO4 | ��ɫ | 2.0��10-12 |
��2����BaCl2��Һ�м���AgNO3��KBr�������ֳ�������ʱ��$\frac{c��B{r}^{-}��}{c��C{l}^{-}��}$=2.7��10-3��
��3���ⶨˮ�����Ȼ���ĺ��������ñ������������еζ����ζ�ʱ��Ӧ�����ָʾ����D��
A��KBr B��KI C��K2S D��K2CrO4��
| A�� | ֻ���������� | B�� | ֻ���л�ԭ�� | ||
| C�� | ����������Ҳ�л�ԭ�� | D�� | ����������Ҳ��ԭ�� |