题目内容
13.下列反应是氧化还原反应的是( )| A. | Cu2(OH)2CO3═2CuO+H2O+CO2↑ | B. | Fe2O3+3H2SO4═Fe2(SO4)3+3H2O | ||
| C. | CO2+Ca(OH)2=CaCO3↓+H2O | D. | 2Al+Fe2O3═Al2O3+2Fe |
分析 氧化还原反应的实质为电子的转移,特征为化合价升降,则反应中存在化合价变化的反应为氧化还原反应,没有化合价变化的反应为非氧化还原反应,据此进行解答.
解答 解:A.Cu2(OH)2CO3═2CuO+H2O+CO2↑为分解反应,反应中没有元素化合价变化,不属于氧化还原反应,故A不选;
B.Fe2O3+3H2SO4═Fe2(SO4)3+3H2O中不存在化合价变化,不属于氧化还原反应,故B不选;
C.CO2+Ca(OH)2=CaCO3↓+,不存在化合价变化,不属于氧化还原反应,故C不选;
D.2Al+Fe2O3═Al2O3+2Fe为置换反应,存在化合价变化,属于氧化还原反应中,故D选;
故选D.
点评 本题考查了氧化还原反应的判断,题目难度不大,明确氧化还原反应的实质、特征为解答关键,注意掌握常见反应类型与氧化还原反应的关系,试题有利于提高学生的灵活应用能力.

练习册系列答案
相关题目
4.下列反应中,一定不能自发进行的是( )
| A. | 2KClO3(s)=2KCl(s)+3O2(g)△H=-78.03 kJ•mol-1,△S=494.4 J•mol-1•K-1 | |
| B. | CO(g)=C(s,石墨)+$\frac{1}{2}$O2(g)△H=110.5 kJ•mol-1,△S=-89.4 J•mol-1•K-1 | |
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)△H=-444.3 kJ•mol-1,△S=-280.1 J•mol-1•K-1 | |
| D. | NH4HCO3(s)+CH3COOH(aq)=CH3COONH4 (aq)+CO2(g)+H2O(l)△H=37.30 kJ•mol-1,△S=184.0 J•mol-1•K-1 |
1.某温度下,对可逆反应:2X(g)+Y(g)?Z(g)+W(s)△H>0的下列叙述不正确的是( )
| A. | 容器体积不变,充入与反应体系不反应的N2,反应速率不变;压强不变,充入N2,反应速率减小 | |
| B. | 升高温度时,正反应速率增大,逆反应速率也一定增大 | |
| C. | 恒温恒容下,若X、Y起始物质的量之比为2:1,则X、Y的转化率始终相等 | |
| D. | 恒温恒压下,该反应达到平衡后若只增加Z的量,重新达到平衡,各物质的物质的量之比可能不变 |
8.下列叙述不正确的是( )
| A. | 碳酸氢钠加热可以分解,因为升高温度利于熵增的方向自发进行 | |
| B. | 在温度、压强一定的条件下,自发反应总是向△G=△H-T△S<0的方向进行 | |
| C. | 水结冰的过程不能自发进行的原因是熵减的过程,改变条件也不可能自发进行 | |
| D. | 混乱度减小的吸热反应一定不能自发进行 |
18.在某温度下,可逆反应mA+nB?pC+qD的平衡常数为K,下列说法正确的是( )
| A. | K越大,达到平衡时,反应进行的程度越大 | |
| B. | K越小,达到平衡时,反应物的转化率越大 | |
| C. | K随反应物浓度的改变而改变 | |
| D. | K随温度和压强的改变而改变 |
5.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)?COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol.下列说法不正确的是( )
| A. | 降低温度,H2S浓度减小,表明该反应是放热反应 | |
| B. | 通入CO后,逆反应速率逐渐增大,直至再次平衡 | |
| C. | 反应前H2S物质的量为6mol | |
| D. | CO的平衡转化率为20% |
2.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )
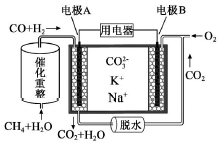

| A. | 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- | |
| B. | 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 反应CH4+H2O $\frac{\underline{催化剂}}{△}$ 3H2+CO,每消耗1molCH4转移12mol 电子 |