题目内容
3.硫酸是基础化工的重要产品,硫酸的消费量可作为衡量一个国家工业发展水平的标志.生产硫酸的主要反应为:2SO2(g)+O2(g)?2SO3(g)
(1)一定温度压强下,SO3的体积分数[ϕ(SO3)]和y与SO2、O2的物质的量之比[$\frac{n(S{O}_{2})}{n({O}_{2})}$]的关系如图1、图2:
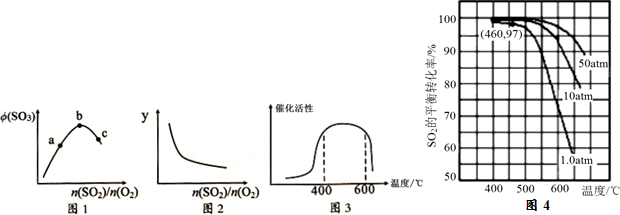
则b点n(SO2)/n(O2)=2:1;y表示的物理量可以是ACD.
A.SO2的转化率 B.O2的转化率C.SO3的平衡产率D.O2的体积分数
(2)Kp是以各气体平衡分压(各气体的分压=总压×各气体的体积分数)代替浓度平衡常数Kc中各气体的浓度的平衡常数.在400~650℃时,Kp与温度(T/K)的关系为lgKp=$\frac{4905.5}{T}$-4.6455,则在此条件下SO2转化为SO3反应的△H<0(填“>0”或“<0”).
(3)该反应的催化剂为V2O5,其催化活性与温度的关系如图3,其催化反应过程为:
①SO2+V2O5?SO3+V2O4 K1
②$\frac{1}{2}$O2+V2O4?V2O5 K2
则在相同温度下2SO2(g)+O2(g)?2SO3(g)的平衡常数K=(K1×K2)2(以含K1、K2的代数式表示).
(4)在7.0% SO2、11% O2、82% N2时,SO2平衡转化率与温度、压强的关系如图4:则460℃、1.0atm下,SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)的Kp=116.5atm1/2.
(5)综合第(3)、(4)题图给信息,工业生产中通常采用压强和温度范围为a.
a.高压400~500℃b.常压400~500℃c.高压500~600℃d.常压500~600.
分析 (1)当二氧化硫的量与氧气的物质的量之比等于系数之比时三氧化硫的体积分数最大;图2表示随着二氧化硫量的增加而逐渐减小的量;
(2)根据图知,升高温度平衡常数减小,说明平衡逆向移动;
(3)将方程式2(①+②)得2SO2(g)+O2(g)?2SO3(g),化学平衡常数K等于(K1×K2)2;
(4)混合气体中7.0% SO2、11% O2、82% N2,假设有混合气体100mol,则二氧化硫为7mol、氧气11mol、氮气82mol,460℃、1.0atm下二氧化硫转化率为97%,则参加反应的n(SO2)=7mol×97%=6.79mol,
剩余的n(SO2)=7mol×3%=0.21mol,
剩余的n(O2)=11mol-$\frac{1}{2}$×6.79mol=7.605mol,生成的三氧化硫物质的量=6.79mol,反应后混合气体总物质的量=0.21mol+7.605mol+6.79mol+82mol=96.605mol,
反应前后物质的量之比等于其压强之比,
则反应后压强=$\frac{0.21mol+7.605mol+6.79mol+82mol}{100mol}$×1atm=0.9579atm,
二氧化硫的分压=$\frac{0.21mol}{96.605mol}$×0.9579atm,
氧气分压=$\frac{7.605mol}{96.605mol}$×0.9579atm,
三氧化硫分压=$\frac{6.79mol}{96.605mol}$×0.9579atm,
化学平衡常数Kp=$\frac{p(S{O}_{3})}{P(S{O}_{2}).\sqrt{P({O}_{2})}}$;
(5)该反应前后气体计量数之和减小,该反应的正反应是放热反应,应该增大压强、降低温度有利于平衡正向移动.
解答 解:(1)当二氧化硫的量与氧气的物质的量之比等于系数之比时三氧化硫的体积分数最大,b点三氧化硫体积分数最大,此点处n(SO2)/n(O2)=2:1;
n(SO2)/n(O2)越大,y值越小,
A.n(SO2)/n(O2)越大,SO2的转化率越小,符合图象,故正确;
B.n(SO2)/n(O2)越大,O2的转化率越大,不符合图象,故错误;
C.n(SO2)/n(O2)越大,二氧化硫物质的量越大,二氧化硫的转化率越小,则SO3的平衡产率越小,不符合图象,故正确;
D.n(SO2)/n(O2)越大,氧气的转化率越大,则O2的体积分数越小,故正确;
故答案为:2:1;ACD;
(2)根据图知,升高温度平衡常数减小,说明平衡逆向移动,正反应是放热反应,焓变小于0,
故答案为:<0;
(3)将方程式2(①+②)得2SO2(g)+O2(g)?2SO3(g),方程式相加平衡常数相乘,方程式扩大2倍,平衡常数变为原来的平方,所以该反应化学平衡常数K等于(K1×K2)2,
故答案为:(K1×K2)2;
(4)混合气体中7.0% SO2、11% O2、82% N2,假设有混合气体100mol,则二氧化硫为7mol、氧气11mol、氮气82mol,460℃、1.0atm下二氧化硫转化率为97%,则参加反应的n(SO2)=7mol×97%=6.79mol,
剩余的n(SO2)=7mol×3%=0.21mol,
剩余的n(O2)=11mol-$\frac{1}{2}$×6.79mol=7.605mol,生成的三氧化硫物质的量=6.79mol,反应后混合气体总物质的量=0.21mol+7.605mol+6.79mol+82mol=96.605mol,
反应前后物质的量之比等于其压强之比,
则反应后压强=$\frac{0.21mol+7.605mol+6.79mol+82mol}{100mol}$×1atm=0.9579atm,
二氧化硫的分压=$\frac{0.21mol}{96.605mol}$×0.9579atm,
氧气分压=$\frac{7.605mol}{96.605mol}$×0.9579atm,
三氧化硫分压=$\frac{6.79mol}{96.605mol}$×0.9579atm,
化学平衡常数Kp=$\frac{p(S{O}_{3})}{P(S{O}_{2}).\sqrt{P({O}_{2})}}$=$\frac{\frac{6.79mol}{96.605mol}×0.9579atm}{\frac{0.21mol}{96.605mol}×0.9579atm×\sqrt{\frac{7.605mol}{96.605mol}×0.9579atm}}$=116.5atm1/2,
故答案为:116.5atm1/2;
(5)该反应前后气体计量数之和减小,该反应的正反应是放热反应,应该增大压强、降低温度有利于平衡正向移动,根据图知,在400~500℃时二氧化硫转化率较大,故选a.
点评 本题考查化学平衡计算、图象分析,为高频考点,侧重考查学生分析推断及计算、知识迁移能力,根据浓度化学平衡常数计算方法计算压强化学平衡常数,计算量较大,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| B. | 1.7g NH3所含原子数为0.1NA | |
| C. | 通常状况下,NA个CO2分子占有的体积约为22.4L | |
| D. | 氧气和臭氧的混合物16 g中含有NA个氧原子 |
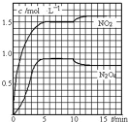 向2L 的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)═2NO2(g)②2NO2(g)═N2O4(g)测得 NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min 后升高并维持容器的温度为T2℃.下列说法正确的是( )
向2L 的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)═2NO2(g)②2NO2(g)═N2O4(g)测得 NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min 后升高并维持容器的温度为T2℃.下列说法正确的是( )| A. | 前 5min 反应的平均速率 v(N2O4)=0.36mol•L-1•min-1 | |
| B. | T1℃时反应②的化学平衡常数K=0.6 | |
| C. | 若起始时向该容器中充入3.6molNO 2和 2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10% | |
| D. | 反应①、②均为吸热反应 |
CO(g)+2H2(g)?CH3OH(g) 实验测得T1℃和 T2℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
| 温度 时间 | 10min | 20min | 30min | 40min | 50min | 60min |
| T1℃ | 0.080 | 0.120 | 0.150 | 0.168 | 0.180 | 0.180 |
| T2℃ | 0.120 | 0.150 | 0.156 | 0.160 | 0.160 | 0.160 |
| A. | 由上述数据可以判断:T1℃>T2℃ | |
| B. | 该反应的焓变△H>0,升高温度K增大. | |
| C. | T1℃时,0~20 min H2的平均反应速率 ν(H2)=0.003mol/(L•min) | |
| D. | T2℃下,向该容器中初始加入0.1 mol CO和0.3 mol H2,依据现有数据可计算出反应达平衡后甲醇的浓度 |
| A. | Cu2(OH)2CO3═2CuO+H2O+CO2↑ | B. | Fe2O3+3H2SO4═Fe2(SO4)3+3H2O | ||
| C. | CO2+Ca(OH)2=CaCO3↓+H2O | D. | 2Al+Fe2O3═Al2O3+2Fe |
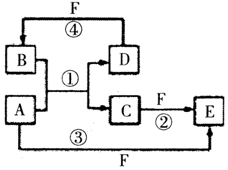 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出),请回答下列问题:
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出),请回答下列问题: ,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.
,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.