题目内容
8.下列叙述不正确的是( )| A. | 碳酸氢钠加热可以分解,因为升高温度利于熵增的方向自发进行 | |
| B. | 在温度、压强一定的条件下,自发反应总是向△G=△H-T△S<0的方向进行 | |
| C. | 水结冰的过程不能自发进行的原因是熵减的过程,改变条件也不可能自发进行 | |
| D. | 混乱度减小的吸热反应一定不能自发进行 |
分析 △H-T△S<0的反应可自发进行,反之不能自发进行,以此来解答.
解答 解:A.碳酸氢钠加热可以分解,生成气体增多,△S>0,即升高温度利于熵增的方向自发进行,故A正确;
B.△G=△H-T△S<0,可自发反应,故B正确;
C.水结冰的过程不能自发进行的原因是熵减的过程,改变条件能自发进行,如降温可发生,故C错误;
D.混乱度减小的吸热反应,△S<0、△H>0,则△H-T△S>0,该反应不能自发进行,故D正确;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握焓变、熵变与反应进行方向的关系为解答的关键,侧重分析与应用能力的考查,注意综合判据的应用,题目难度不大.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
18.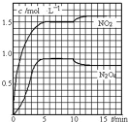 向2L 的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)═2NO2(g)②2NO2(g)═N2O4(g)测得 NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min 后升高并维持容器的温度为T2℃.下列说法正确的是( )
向2L 的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)═2NO2(g)②2NO2(g)═N2O4(g)测得 NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min 后升高并维持容器的温度为T2℃.下列说法正确的是( )
 向2L 的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)═2NO2(g)②2NO2(g)═N2O4(g)测得 NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min 后升高并维持容器的温度为T2℃.下列说法正确的是( )
向2L 的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)═2NO2(g)②2NO2(g)═N2O4(g)测得 NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min 后升高并维持容器的温度为T2℃.下列说法正确的是( )| A. | 前 5min 反应的平均速率 v(N2O4)=0.36mol•L-1•min-1 | |
| B. | T1℃时反应②的化学平衡常数K=0.6 | |
| C. | 若起始时向该容器中充入3.6molNO 2和 2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10% | |
| D. | 反应①、②均为吸热反应 |
19.某浓度的氨水中存在下列平衡:NH3•H2O?NH${\;}_{4}^{+}$+OH-,如果增大NH${\;}_{4}^{+}$的浓度,而不增大OH-的浓度,应采取的措施是( )
| A. | 加入氯化铵固体 | B. | 适当升高温度 | C. | 通入氨气 | D. | 加入少量浓盐酸 |
3.一定温度下,将0.1molAgCl加入1L 0.1mol•L-1Na2CO3溶液中,充分搅拌(不考虑液体体积变化),已知:Ksp(AgCl)=2×10-10;Ksp(Ag2CO3)=1×10-11,下列有关说法正确的是( )
| A. | 沉淀转化反应2AgCl(s)+CO32-(aq)?Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol•L-1 | |
| B. | 约有2×10-5mol AgCl溶解 | |
| C. | 反应后溶液中的:c(Na+)>c (Cl-)>c (CO32-)>c (OH-)>c (H+) | |
| D. | 反应后溶液中的:c(Na+)+c (H+)+c (Ag+)=2 c (CO32-)+c (HCO3-)+c (Cl-)+c (OH-) |
13.下列反应是氧化还原反应的是( )
| A. | Cu2(OH)2CO3═2CuO+H2O+CO2↑ | B. | Fe2O3+3H2SO4═Fe2(SO4)3+3H2O | ||
| C. | CO2+Ca(OH)2=CaCO3↓+H2O | D. | 2Al+Fe2O3═Al2O3+2Fe |
18.下列反应的离子方程式书写正确的是( )
| A. | NaHSO4溶液中加入Ba(OH)2溶液后恰好显中性Ba2++OH-+H++SO42-═BaSO4+H2O | |
| B. | 向澄清石灰水中通入过量CO2:OH-+CO2═HCO3- | |
| C. | 氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
 工业上生产硝酸的主要过程如下:
工业上生产硝酸的主要过程如下: