题目内容
2.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )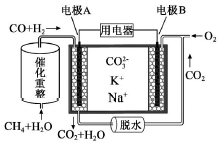
| A. | 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- | |
| B. | 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 反应CH4+H2O $\frac{\underline{催化剂}}{△}$ 3H2+CO,每消耗1molCH4转移12mol 电子 |
分析 原电池工作时,CO和H2失电子在负极反应,则A为负极,CO和H2被氧化生成二氧化碳和水,正极B上为氧气得电子生成CO32-,以此解答该题.
解答 解:A.B为正极,正极为氧气得电子生成CO32-,反应为O2+2CO2+4e-=2CO32-,故A正确;
B.A是负极,负极上CO和H2被氧化生成二氧化碳和水,电极A反应为:H2+CO+2CO32--4e-=H2O+3CO2,故B错误;
C.放电时,电解质中阴离子向负极移动,即向A极移动,故C错误;
D.该反应中1mol甲烷完全反应转移电子6mol电子,故D错误;
故选A.
点评 本题考查化学电源新型电池,为高频考点,根据得失电子判断正负极,侧重考查学生分析判断能力,难点是电极反应式的书写,要结合电解质特点书写.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
13.下列反应是氧化还原反应的是( )
| A. | Cu2(OH)2CO3═2CuO+H2O+CO2↑ | B. | Fe2O3+3H2SO4═Fe2(SO4)3+3H2O | ||
| C. | CO2+Ca(OH)2=CaCO3↓+H2O | D. | 2Al+Fe2O3═Al2O3+2Fe |
7.下列叙述中,正确的是( )
| A. | 聚乙烯、植物油都是混合物,都能使溴的四氯化碳溶液褪色 | |
| B. | 向氯乙烷中加入硝酸银溶液,可以快速鉴定其中的氯原子 | |
| C. | 将等体积的苯、汽油和水在试管中充分振荡后静置,现象如图 | |
| D. | 直馏汽油和裂化汽油中分别滴加溴水可以观察到不同现象 |
14.在硫酸溶液中滴入下列溶液,可使其导电性明显减小的是( )
| A. | NaOH | B. | Ba(NO3)2 | C. | Na2CO3 | D. | Ba(OH)2 |
11.用铂电极分别电解下列物质的溶液,阴极和阳极上同时都有气体产生且溶液的pH下降的是( )
| A. | KCl | B. | CuSO4 | C. | HCl | D. | H2SO4 |
12.用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是( )
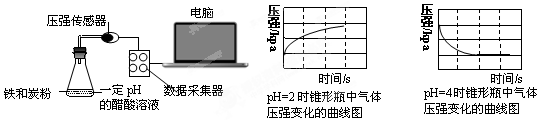

| A. | 溶液pH≤2时,生铁发生析氢腐蚀 | |
| B. | 生铁的腐蚀中化学腐蚀比电化学腐蚀更普遍 | |
| C. | 在酸性溶液中生铁可能发生吸氧腐蚀 | |
| D. | 两溶液中负极反应均为:Fe-2e-═Fe2+ |