题目内容
3.已知H2的燃烧热为285.8kJ•mol-1,S的燃烧热为296kJ•mol-1,H2S气体燃烧热为561.7kJ•mol-1(H2S气体完全燃烧生成物是SO2和水),则硫与氢气反应的热化学方程式为H2(g)+S(s)=H2S(g)△H=-20.1 kJ•mol-1,依据“焓判据”判定此反应是自发(填:“自发”或“非自发”)反应.分析 氢气的燃烧热热化学方程式为:①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 kJ/mol,S的燃烧热为296kJ•mol-1,S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1,③H2S气体燃烧热为561.7kJ•mol-1,热化学方程式为:②H2S(g)+$\frac{3}{2}$O2(g)=H2O(l)+SO2(g),△H=-561.7kJ•mol-1,根据盖斯定律,①+②-③得到H2(g)+S(s)=H2S(g),据此计算硫与氢气反应的焓变,根据放热反应有利于反应自发进行来回答.
解答 解:氢气的燃烧热热化学方程式为:①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 kJ/mol,S的燃烧热为296kJ•mol-1,S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1,③H2S气体燃烧热为561.7kJ•mol-1,热化学方程式为:②H2S(g)+$\frac{3}{2}$O2(g)=H2O(l)+SO2(g),△H=-561.7kJ•mol-1,根据盖斯定律,得到H2(g)+S(s)=H2S(g),△H=-20.1 kJ•mol-1,放热反应有利于反应自发进行,
故答案为:H2(g)+S(s)=H2S(g)△H=-20.1 kJ•mol-1;自发.
点评 本题考查学生盖斯定律的应用和反应能否自发进行的条件来判断,据此回答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列反应是氧化还原反应的是( )
| A. | Cu2(OH)2CO3═2CuO+H2O+CO2↑ | B. | Fe2O3+3H2SO4═Fe2(SO4)3+3H2O | ||
| C. | CO2+Ca(OH)2=CaCO3↓+H2O | D. | 2Al+Fe2O3═Al2O3+2Fe |
14.在硫酸溶液中滴入下列溶液,可使其导电性明显减小的是( )
| A. | NaOH | B. | Ba(NO3)2 | C. | Na2CO3 | D. | Ba(OH)2 |
11.用铂电极分别电解下列物质的溶液,阴极和阳极上同时都有气体产生且溶液的pH下降的是( )
| A. | KCl | B. | CuSO4 | C. | HCl | D. | H2SO4 |
18.下列反应的离子方程式书写正确的是( )
| A. | NaHSO4溶液中加入Ba(OH)2溶液后恰好显中性Ba2++OH-+H++SO42-═BaSO4+H2O | |
| B. | 向澄清石灰水中通入过量CO2:OH-+CO2═HCO3- | |
| C. | 氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
8.如图是某反应在密闭容器中反应前后的分子状况示意图,“ ”和“
”和“ ”分别表示不同的原子.下列对此反应的分类一定不正确的是( )
”分别表示不同的原子.下列对此反应的分类一定不正确的是( )

 ”和“
”和“ ”分别表示不同的原子.下列对此反应的分类一定不正确的是( )
”分别表示不同的原子.下列对此反应的分类一定不正确的是( )
| A. | 化合反应 | B. | 可逆反应 | C. | 置换反应 | D. | 氧化还原反应 |
15.下列实验操作正确的是( )
| A. | 制取蒸馏水时,为了防止瓶内产生暴沸现象,应先向烧瓶内加入几片碎瓷片 | |
| B. | 稀释浓硫酸时,常把水加入到盛浓硫酸的烧杯中 | |
| C. | 做CO还原Fe2O3实验时,为防止CO污染环境,实验完毕,常先停止通CO,再停止加热 | |
| D. | 进行硫酸铜溶液的浓缩结晶实验需要的仪器主要有烧杯、玻璃棒、蒸发皿 |
12.用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是( )
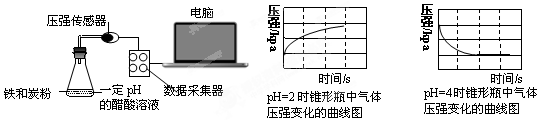

| A. | 溶液pH≤2时,生铁发生析氢腐蚀 | |
| B. | 生铁的腐蚀中化学腐蚀比电化学腐蚀更普遍 | |
| C. | 在酸性溶液中生铁可能发生吸氧腐蚀 | |
| D. | 两溶液中负极反应均为:Fe-2e-═Fe2+ |
16.羰基硫(O=C=S)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染.羰基硫的氢解反应和水解反应是两种常用的脱硫方法,其反应式分别为:
①氢解反应:COS(g)+H2(g)?H2S(g)+CO(g)△H1=+7KJ•mol-1
②水解反应:COS(g)+H2O(g)?H2S(g)+CO2(g)△H2
已知反应中相关的化学键键能数据如下:
回答下列问题: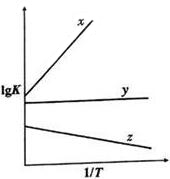
(1)在以上脱除COS的反应中,若某反应有1mol电子发生转移,则该反应吸收的热量为3.5KJ.
(2)已知热化学方程式CO(g)+H2O(g)?H2(g)+CO2(g)△H3 则△H3=-42KJ•mol-1.
(3)氢解反应平衡后增大容器的体积,则正反应速率减小,COS的转化率不变(填“增大”或“减小”或“不变”).
(4)COS氢解反应的平衡常数K与温度T具有如下的关系式lgK=$\frac{a}{T}$+b,式中a和b均为常数.
①如图中,表示COS氢解反应的直线为z,判断依据为氢解反应为吸热反应,升高温度,k增大.
②一定条件下,催化剂A和B对COS的氢解均具有催化作用,相关数据如下表所示:
则a1=a2(填“>”或“<”或“=”),判断a1和a2大小的依据为K的数值只与温度有关,与催化剂无关.
③某温度下,在体积不变的容器中,若COS和H2的起始体积比为1:V,平衡后COS和H2的体积比为1:10V,则此温度下该反应的化学平衡常数K=$\frac{81V}{10(V-1)^{2}}$.
①氢解反应:COS(g)+H2(g)?H2S(g)+CO(g)△H1=+7KJ•mol-1
②水解反应:COS(g)+H2O(g)?H2S(g)+CO2(g)△H2
已知反应中相关的化学键键能数据如下:
| 化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
| E/(KJ•mol-1) | 803 | 742 | 577 | 339 | 465 |

(1)在以上脱除COS的反应中,若某反应有1mol电子发生转移,则该反应吸收的热量为3.5KJ.
(2)已知热化学方程式CO(g)+H2O(g)?H2(g)+CO2(g)△H3 则△H3=-42KJ•mol-1.
(3)氢解反应平衡后增大容器的体积,则正反应速率减小,COS的转化率不变(填“增大”或“减小”或“不变”).
(4)COS氢解反应的平衡常数K与温度T具有如下的关系式lgK=$\frac{a}{T}$+b,式中a和b均为常数.
①如图中,表示COS氢解反应的直线为z,判断依据为氢解反应为吸热反应,升高温度,k增大.
②一定条件下,催化剂A和B对COS的氢解均具有催化作用,相关数据如下表所示:
| 达到平衡所需的时间/min | a的数值 | b的数值 | |
| 催化剂A | t | a1 | b1 |
| 催化剂B | 2t | a2 | b2 |
③某温度下,在体积不变的容器中,若COS和H2的起始体积比为1:V,平衡后COS和H2的体积比为1:10V,则此温度下该反应的化学平衡常数K=$\frac{81V}{10(V-1)^{2}}$.