题目内容
1.某温度下,对可逆反应:2X(g)+Y(g)?Z(g)+W(s)△H>0的下列叙述不正确的是( )| A. | 容器体积不变,充入与反应体系不反应的N2,反应速率不变;压强不变,充入N2,反应速率减小 | |
| B. | 升高温度时,正反应速率增大,逆反应速率也一定增大 | |
| C. | 恒温恒容下,若X、Y起始物质的量之比为2:1,则X、Y的转化率始终相等 | |
| D. | 恒温恒压下,该反应达到平衡后若只增加Z的量,重新达到平衡,各物质的物质的量之比可能不变 |
分析 A.容器体积不变,充入不反应的氮气,参加反应的各物质浓度不变;压强不变充入氮气,容器体积增大参加反应的气体浓度降低;
B.升高温度正逆反应速率都增大;
C.恒温恒容条件下,如果各反应物的起始物质的量之比等于其计量数之比,则各反应物的转化率相等;
D.恒温恒压条件下,该反应达到平衡后若只增加Z的量,容器体积增大,Z的浓度不变但X和Y浓度降低,平衡逆向移动.
解答 解:A.容器体积不变,充入不反应的氮气,参加反应的各物质浓度不变,则反应速率不变;压强不变充入氮气,容器体积增大参加反应的气体浓度降低,则反应速率减小,故A正确;
B.升高温度增大活化分子百分数,所以正逆反应速率都增大,故B正确;
C.恒温恒容条件下,如果各反应物的起始物质的量之比等于其计量数之比,则各反应物的转化率相等,所以恒温恒容下,若X、Y起始物质的量之比为2:1,则X、Y的转化率始终相等,故C正确;
D.恒温恒压条件下,该反应达到平衡后若只增加Z的量,容器体积增大,Z的浓度不变但X和Y浓度降低,平衡逆向移动,所以各物质的物质的量之比一定改变,故D错误;
故选D.
点评 本题考查化学反应平衡影响因素,为高频考点,侧重考查学生分析判断能力,明确恒温恒压、恒温恒容的区别是解本题关键,注意分析压强增大时是否导致参加反应的各物质浓度改变,如果发生改变的,则发生平衡移动,否则不发生平衡移动,为易错题.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
9.已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1 452kJ•mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1下列说法正确的是( )
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1 452kJ•mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1下列说法正确的是( )
| A. | H2(g)的燃烧热为571.6 kJ•mol-1 | |
| B. | $\frac{1}{2}$H2SO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═$\frac{1}{2}$BaSO4(s)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | |
| D. | 3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=-131.4 kJ•mol-1 |
13.下列反应是氧化还原反应的是( )
| A. | Cu2(OH)2CO3═2CuO+H2O+CO2↑ | B. | Fe2O3+3H2SO4═Fe2(SO4)3+3H2O | ||
| C. | CO2+Ca(OH)2=CaCO3↓+H2O | D. | 2Al+Fe2O3═Al2O3+2Fe |
11.用铂电极分别电解下列物质的溶液,阴极和阳极上同时都有气体产生且溶液的pH下降的是( )
| A. | KCl | B. | CuSO4 | C. | HCl | D. | H2SO4 |
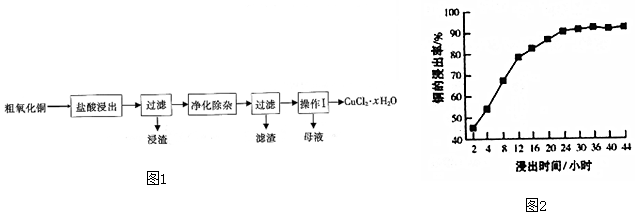
 工业上生产硝酸的主要过程如下:
工业上生产硝酸的主要过程如下: 已知:2NO2(g)?N2O4(g)△H=-52.7kJ/mol,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
已知:2NO2(g)?N2O4(g)△H=-52.7kJ/mol,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验: