题目内容
12.硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是工业生产硫酸产生的废渣,其综合利用对环境保护具有现实意义.利用硫铁矿烧渣制备铁红等产品的实验流程如图1:
已知几种盐的溶解度随温度变化的曲线如图2所示:
回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是Fe2+.
(2)煅烧FeCO3生成产品I和CO2的化学反应方程式为4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2.实验室进行煅烧操作所需仪器除了酒精灯、泥三角、三脚架、玻璃棒外,还有坩埚、坩埚钳.
(3)生成产品II的化学方程式为(NH4)2SO4+2KCl=K2SO4↓+2NH4Cl.为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是:蒸发结晶、趁热过滤、洗涤、干燥.
分析 利用硫铁矿烧渣制备铁红等产品的实验流程为:Fe2O3、Fe3O4、FeO与还原剂反应生成铁,铁和稀硫酸反应生成硫酸亚铁和氢气,过滤后所以滤液中的主要溶质是硫酸亚铁;硫酸亚铁与碳酸氢铵反应得到碳酸亚铁和硫酸铵;碳酸亚铁与氧气反应生成了氧化铁、二氧化碳;硫酸铵与氯化钾反应生成硫酸钾和氯化铵,根据硫酸钾的溶解度随温度变化不大,可用蒸发结晶、趁热过滤、洗涤、干燥得到硫酸钾,以此解答该题.
(1)Fe2O3、Fe3O4、FeO与还原剂反应生成铁,酸浸能与稀硫酸反应得到Fe2+、SiO2不能与稀硫酸反应;
(2)根据图示,碳酸亚铁煅烧生成氧化铁和二氧化碳气体;根据煅烧操作的方法写出使用的仪器名称;
(3)硫酸铵与氯化钾反应生成硫酸钾和氯化铵,根据硫酸钾的溶解度随温度变化不大,可用蒸发结晶、趁热过滤、洗涤、干燥得到硫酸钾.
解答 解:利用硫铁矿烧渣制备铁红等产品的实验流程为:Fe2O3、Fe3O4、FeO与还原剂反应生成铁,铁和稀硫酸反应生成硫酸亚铁和氢气,过滤后所以滤液中的主要溶质是硫酸亚铁;硫酸亚铁与碳酸氢铵反应得到碳酸亚铁和硫酸铵;碳酸亚铁与氧气反应生成了氧化铁、二氧化碳;硫酸铵与氯化钾反应生成硫酸钾和氯化铵,根据硫酸钾的溶解度随温度变化不大,可用蒸发结晶、趁热过滤、洗涤、干燥得到硫酸钾.
(1)Fe2O3、Fe3O4、FeO与还原剂反应生成铁,铁和稀硫酸反应生成硫酸亚铁和氢气,所以滤液中的主要溶质是硫酸亚铁,过滤后滤液中的金属阳离子是Fe2+,
故答案为:Fe2+;
(2)碳酸亚铁与氧气反应生成了氧化铁盒二氧化碳,反应的化学方程式为:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2;因实验室进行煅烧操作所需仪器有:酒精灯、泥三角、三脚架、玻璃棒、坩埚、坩埚钳,还缺少的仪器为:坩埚、坩埚钳,
故答案为:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2; 坩埚、坩埚钳;
(3)硫酸铵与氯化钾反应生成硫酸钾和氯化铵,反应方程式为(NH4)2SO4+2KCl=K2SO4↓+2NH4Cl;因硫酸钾的溶解度随温度变化不大,可用蒸发结晶、趁热过滤、洗涤、干燥得到硫酸钾,
故答案为:(NH4)2SO4+2KCl=K2SO4↓+2NH4Cl;蒸发结晶、趁热过滤.
点评 本题综合考查物质的分离、提纯以及制备,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握实验的目的和原理,难度不大.

| A. | 该溶液中氢离子的浓度:c(H+)=1×10-11 mol/L | |
| B. | 0.1 mol/L氨水溶液与0.1 mol/L HCl溶液等体积混合后所得溶液中:c(NH4+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | 0.1 mol/L的氨水溶液与0.05 mol/L H2SO4溶液等体积混合后所得溶液中:c(NH4+)+c(NH3•H2O)=2c(SO42-) | |
| D. | 浓度均为0.1 mol/L的NH3•H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则c(NH4+)>c(NH3•H2O)>c(Cl-)>c(OH-)>c(H+) |
| A. | 体积比为8:1 | B. | 分子个数之比为11:12 | ||
| C. | 密度之比为8:11 | D. | 原子个数之比为11:12 |
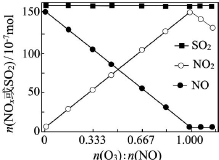 烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为: 向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的PH>7.
向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的PH>7.