题目内容
20. 向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的PH>7.
向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的PH>7.(1)此时溶液的溶质若是单一成分,可能是Na2CO3或NaHCO3;如果是多种成分,可能是NaOH和Na2CO3或Na2CO3和NaHCO3.
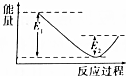
(2)在上述所得溶液中,逐滴缓慢滴加1mol/L的盐酸,所得气体的体积与所加盐酸的体积(不考虑溶解于水)关系如图所示.
①加入盐酸200mL之前,无气体产生,写出OA段发生反应的离子方程式OH-+H+═H2O、CO32-+H+═HCO3-;
②产生的CO2在标准状况下的体积为2240mL;
③B点时,反应所得溶液中溶质的物质的量浓度是0.75mol/L.
分析 (1)CO2与NaOH反应可生成Na2CO3或NaHCO3,二者溶液都呈碱性;如果是多种成分,可能是二者混合物,也可能NaOH有剩余;
(2)①加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,A→C段发生
NaHCO3+HCl═NaCl+H2O+CO2↑,而O→A段消耗的盐酸为A→B消耗的盐酸的二倍,应为NaOH和Na2CO3的混合物,都可与盐酸反应,据此写出反应的离子方程式;AB段碳酸氢根离子与氯化氢反应生成二氧化碳气体;
②根据AB段消耗氯化氢溶液的体积及氯化氢的浓度计算出生成二氧化碳的物质的量及标况下的体积;
③AB段发生反应为NaHCO3+HCl═NaCl+H2O+CO2↑,根据氢氧化钠的物质的量计算出溶质氯化钠的浓度.
解答 解:(1)CO2与NaOH反应可生成Na2CO3或NaHCO3,二者溶液都呈碱性,则如果是单一成分,可能是
Na2CO3或NaHCO3,如果是多种成分,若1<$\frac{n(NaOH)}{n(CO2)}$<2,溶质是NaHCO3、Na2CO3.若$\frac{(NaOH)}{n(CO2)}$>2,溶质是Na2CO3、NaOH,
故答案为:Na2CO3或NaHCO3;NaOH和Na2CO3或Na2CO3和NaHCO3;
(2)①加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,A→C段发生NaHCO3+HCl═NaCl+H2O+CO2↑,而O-A段消耗的盐酸为A→B的二倍,反应产物应为NaOH和Na2CO3的混合物,二者都可与盐酸反应,反应的离子方程式分别为:OH-+H+═H2O、CO32-+H+═HCO3-;
故答案为:OH-+H+═H2O;CO32-+H+═HCO3-;
②根据反应方程式CO32-+H+═HCO3-、HCO3-+H+=CO2↑+H2O可知,碳酸钠消耗盐酸的体积为100mL,则氢氧化钠消耗的盐酸体积也是100mL,即Na2CO3与NaOH的物质的量相等,根据钠离子守恒,则碳酸钠的物质的量为:$\frac{1}{3}$×(3mol/L×0.1L)=0.1mol,根据碳原子守恒,反应生成二氧化碳的物质的量为0.1mol,标况下0.1mol二氧化碳的体积为:22.4L/mol×0.1mol=2.24L=2240mL,
故答案为:2240;
③B点时溶质为氯化钠,根据氢氧化钠的物质的量可知NaCl的物质的量为:0.1L×3mol/L=0.3mol,
则NaCl的物质的量浓度是:$\frac{0.3mol}{0.3+0.1L}$=0.75mol/L,
故答案为:0.75.
点评 本题考查混合物的计算,题目难度中等,注意从图象分析反应可能的情况进行判断和计算,本题关键是根据图象判断溶液溶质的成分,注意在计算过程中守恒思想的应用.

 研究硫酸工业原理及含硫化合物的性质具有重要意义.
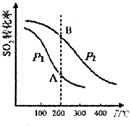
研究硫酸工业原理及含硫化合物的性质具有重要意义.(1)硫酸工业生产中涉及反应:2SO2(g)+O2(g)?2SO3(g)△H<0,SO2的平衡转化率与温度、压强的关系如右图所示,则:
①压强:P1<P2(填“>”、“=”或“<”).
②A、B两点的平衡常数:K(A)=K(B)(填“>”、“=”或“<”).
③200℃时,将一定量的SO2和O2充入容积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
| 气体 | SO2 | O2 | SO3 |
| 浓度(mol•L-1) | 0.4 | 1.2 | 1.6 |
a.v正(O2)=v逆(SO3) b.SO2和SO3物质的量之和保持不变
c.混合气体的密度保持不变 d.体系的压强保持不变
(2)Cu2S在高温条件下发生如下反应:2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-773kJ•mol-1
当该反应有1.2mol电子转移时,反应释放出的热量为77.3kJ.
(3)某研究小组把钢铁中的硫转化为H2SO3溶液,然后用标准浓度的I2溶液进行滴定,滴定中使用的指示剂为淀粉试液(写名称),滴定过程中c(SO32-)减小(填“增大”、“减小”或“不变”).
(4)利用反应2SO2+O2+2H2O═2H2SO4可以处理SO2尾气,若将该反应设计为原电池,用稀硫酸作电解质溶液,其正极电极反应式为4H++O2+4e-═2H2O.
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量>生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则含1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
| A. | +184.6KJ•mol-1 | B. | 92.3KJ•mol-1 | C. | -369.2KJ•mol-1 | D. | +92.3KJ•mol-1 |




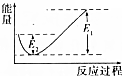
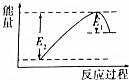
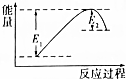
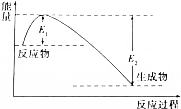 如图所示的是1molNO2和足量的CO完全反应生成CO2和NO过程中的能量变化示意图,能够表示出CO2+NO=NO2+CO的能量变化示意图的是( )
如图所示的是1molNO2和足量的CO完全反应生成CO2和NO过程中的能量变化示意图,能够表示出CO2+NO=NO2+CO的能量变化示意图的是( )