题目内容
1.我校环保兴趣小组在处理工业污水样品时,需用硫酸铜晶体(CuSO4•5H2O)配制成1000mL 0.1mol•L-1的硫酸铜溶液.(1)需用托盘天平称25.0 g硫酸铜晶体.
(2)在称取硫酸铜晶体后,下列操作先后顺序是(用编号表示)③①④②
①待硫酸铜溶液温度与室温一致后,沿玻璃棒注入所选定规格的容量瓶中.
②往容量瓶中小心加蒸馏水至液面接近环形刻度线1~2cm处,改用胶头滴管加蒸馏水,使凹液面最低处与瓶颈的环形刻度线相切.
③在盛有硫酸铜晶体的烧杯中注入适量蒸馏水,并用玻璃棒搅动,使其充分溶解.
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶.
(3)在容量瓶的使用方法中,下列操作正确的是ACE.
A、使用容量瓶前检查它是否漏水
B、容量瓶用水洗净后,再用配好的硫酸铜溶液润洗
C、若配制450mL硫酸铜溶液,则选择500mL的容量瓶
D、配制溶液时,若试样是液体,用量筒取试样后直接倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
E、盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
(4)试分析下列操作对所配溶液的浓度有何影响(填“偏高”,“偏低”或“无影响”).
①未洗涤烧杯和玻璃棒,使所配溶液浓度偏低;
②定容时俯视刻度线,使所配溶液浓度偏高;
③摇匀后,发现液面低于刻度线,又滴加蒸馏水,使所配溶液浓度偏低.
分析 (1)依据m=CVM计算需要溶质的质量;
(2)依据配制一定物质的量浓度溶液一般步骤排序;
(3)A.容量瓶使用时需要上下颠倒,所以使用前应检查是否漏水;
B.配好的硫酸铜溶液润洗,导致溶质物质的量偏大;
C.依据配制溶液体积及容量瓶规格选择;
D.容量瓶为精密仪器,不能用来稀释浓溶液;
E.依据摇匀的正确操作解答;
(4)分析操作对溶质物质的量、溶液体积的影响,根据c=$\frac{n}{V}$判断对溶液浓度的影响.
解答 解:(1)配制成1000mL 0.1mol•L-1的硫酸铜溶液,需要溶质的质量m=1L×0.1mol/L×250g/mol=25.0g;
故答案为:25.0;
(2)配制一定物质的量浓度溶液一般步骤为:计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶等,所以正确的步骤为:③①④②;
故答案为:③①④②;
(3)A.容量瓶使用时需要上下颠倒,所以使用前应检查是否漏水,故A正确;
B.配好的硫酸铜溶液润洗,导致溶质物质的量偏大,所配溶液浓度偏大,故B错误;
C.若配制450mL硫酸铜溶液,则选择500mL的容量瓶,故C正确;
D.配制溶液时,若试样是液体,用量筒取试样后应先在烧杯中稀释,然后再转移到入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线,故D错误;
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀,故E正确;
故选:ACE;
(4)①未洗涤烧杯和玻璃棒,导致溶质的物质的量偏小,使所配溶液浓度偏低;
②定容时俯视刻度线,导致溶液体积偏小,使所配溶液浓度偏大;
③摇匀后,发现液面低于刻度线,又滴加蒸馏水,使所配溶液浓度,导致溶液体积偏大,溶液浓度偏低;
故答案为:偏低;偏高;偏低.
点评 本题考查了一定物质的量浓度的溶液配制方法,题目难度不大,注意掌握配制一定浓度的溶液步骤,能够根据配制步骤正确选用仪器,注意误差分析的方法可技巧.

| A. | 金属钠存放于煤油中 | |
| B. | 硝酸贮存在避光低温处 | |
| C. | 在盛溴的试剂瓶中加一定量的水液封,防止溴的挥发 | |
| D. | 单质碘贮存在棕色的细口瓶中 |
| A. | 石墨 | B. | 铜 | C. | 氯化钠溶液 | D. | 固体氯化钾 |
| A. | 一定条件下,气体体积大小取决于气体分子的大小 | |
| B. | 一定条件下,气体体积大小取决于其物质的量的多少 | |
| C. | 1mol任何气体所占的体积为22.4L,称为气体摩尔体积 | |
| D. | 体积不相等的两种气体所含的分子数也一定不相等 |
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
(2)实验①和②的目的是探究浓度对反应速率的影响.实验时由于较长时间没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中).
(3)写出实验③的化学反应方程式2H2O2$\frac{\underline{\;氯化铁\;}}{\;}$2H2O+O2↑.
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.

分析上图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.




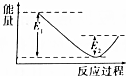
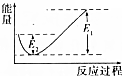
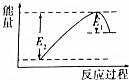
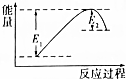
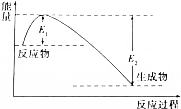 如图所示的是1molNO2和足量的CO完全反应生成CO2和NO过程中的能量变化示意图,能够表示出CO2+NO=NO2+CO的能量变化示意图的是( )
如图所示的是1molNO2和足量的CO完全反应生成CO2和NO过程中的能量变化示意图,能够表示出CO2+NO=NO2+CO的能量变化示意图的是( )