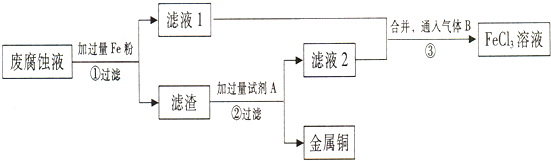
题目内容
3. 烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:NO(g)+O3(g)═NO2(g)+O2(g)△H=-200.9kJ•mol-1
NO(g)+$\frac{1}{2}$O2(g)═NO2(g)△H=-58.2kJ•mol-1
SO2(g)+O3(g)=SO3(g)+O2(g)△H=-241.6kJ•mol-1
(1)反应3NO(g)+O3(g)=3NO2(g)的△H=-317.3mol•L-1.
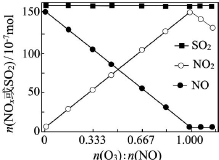
(2)室温下,固定进入反应器的NO、SO2的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):n(NO)的变化见图.
①当n(O3):n(NO)>1时,反应后NO2的物质的量减少,其原因是O3将NO2氧化成更高价氮氧化物.
②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是SO2与O3的反应速率慢.
(3)当用CaSO3水悬浮液吸收经O3预处理的烟气时,清液(pH约为 8)中SO32-将NO2转化为NO2-,其离子方程式为:SO32-+2NO2+2OH-=SO42-+2NO2-+H2O.
(4)CaSO3水悬浮液中加入Na2SO4溶液,达到平衡后溶液中c(SO32-)=$\frac{Ksp(CaS{O}_{3})}{Ksp(CaS{O}_{4})}×c(S{{O}_{4}}^{2-})$[用c(SO42-)、Ksp(CaSO3)和Ksp(CaSO4)表示];CaSO3水悬浮液中加入Na2SO4溶液能提高NO2的吸收速率,其主要原因是CaSO3转化为CaSO4使溶液中SO32-的浓度增大,加快SO32-与NO2的反应速率.
分析 (1)已知:①NO(g)+O3(g)═NO2(g)+O2(g)△H=-200.9kJ•mol-1
②NO(g)+$\frac{1}{2}$O2(g)═NO2(g)△H=-58.2kJ•mol-1
由盖斯定律可知,①+②×2得3NO(g)+O3(g)=3NO2(g),据此计算;
(2)①根据O3的强氧化性分析;
②SO2与O3的反应速率很慢;
(3)SO32-将NO2转化为NO2-,N元素的化合价降低,则S元素的化合价升高,所以SO32-被氧化为SO42-;
(4)CaSO3水悬浮液中加入Na2SO4溶液,溶液中存在CaSO3+SO42-?CaSO4+SO32-,根据Ks计算;根据CaSO3+SO42-?CaSO4+SO32-的平衡移动影响因素.
解答 解:(1)已知:①NO(g)+O3(g)═NO2(g)+O2(g)△H=-200.9kJ•mol-1
②NO(g)+$\frac{1}{2}$O2(g)═NO2(g)△H=-58.2kJ•mol-1
由盖斯定律可知,①+②×2得3NO(g)+O3(g)=3NO2(g),△H=-317.3kJ/mol;
故答案为:-317.3;
(2)①O3具有强氧化性,当n(O3):n(NO)>1时,过量的O3会将NO2氧化为更高价态的化合物;
故答案为:O3将NO2氧化成更高价氮氧化物;
②SO2具有较强的还原性,增加O3量,SO2的量几乎没有变化,说明SO2与O3的反应速率很慢;
故答案为:SO2与O3的反应速率很慢;
(3)SO32-将NO2转化为NO2-,N元素的化合价降低,则S元素的化合价升高,所以SO32-被氧化为SO42-,其反应的离子方程式为:SO32-+2NO2+2OH-=SO42-+2NO2-+H2O;
故答案为:SO32-+2NO2+2OH-=SO42-+2NO2-+H2O;
(4)CaSO3水悬浮液中加入Na2SO4溶液,溶液中存在CaSO3+SO42-?CaSO4+SO32-,则c(SO32-)=$\frac{Ksp(CaS{O}_{3})}{Ksp(CaS{O}_{4})}×c(S{{O}_{4}}^{2-})$;CaSO3水悬浮液中加入Na2SO4溶液,由CaSO3+SO42-?CaSO4+SO32-可知溶液中SO32-的浓度增大,加快SO32-与NO2的反应速率;
故答案为:CaSO3转化为CaSO4使溶液中SO32-的浓度增大,加快SO32-与NO2的反应速率.
点评 本题考查了盖斯定律的应用、影响反应速率的因素、化学平衡移动、溶度积常数的应用等,题目综合性较强,难度中等,侧重于考查学生对化学原理的应用能力和计算能力.

 阅读快车系列答案
阅读快车系列答案| A. | 石墨 | B. | 铜 | C. | 氯化钠溶液 | D. | 固体氯化钾 |
| A. | 1:3 | B. | 1:4 | C. | 1:5 | D. | 2:3 |
 研究硫酸工业原理及含硫化合物的性质具有重要意义.
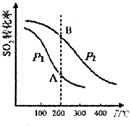
研究硫酸工业原理及含硫化合物的性质具有重要意义.(1)硫酸工业生产中涉及反应:2SO2(g)+O2(g)?2SO3(g)△H<0,SO2的平衡转化率与温度、压强的关系如右图所示,则:
①压强:P1<P2(填“>”、“=”或“<”).
②A、B两点的平衡常数:K(A)=K(B)(填“>”、“=”或“<”).
③200℃时,将一定量的SO2和O2充入容积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
| 气体 | SO2 | O2 | SO3 |
| 浓度(mol•L-1) | 0.4 | 1.2 | 1.6 |
a.v正(O2)=v逆(SO3) b.SO2和SO3物质的量之和保持不变
c.混合气体的密度保持不变 d.体系的压强保持不变
(2)Cu2S在高温条件下发生如下反应:2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-773kJ•mol-1
当该反应有1.2mol电子转移时,反应释放出的热量为77.3kJ.
(3)某研究小组把钢铁中的硫转化为H2SO3溶液,然后用标准浓度的I2溶液进行滴定,滴定中使用的指示剂为淀粉试液(写名称),滴定过程中c(SO32-)减小(填“增大”、“减小”或“不变”).
(4)利用反应2SO2+O2+2H2O═2H2SO4可以处理SO2尾气,若将该反应设计为原电池,用稀硫酸作电解质溶液,其正极电极反应式为4H++O2+4e-═2H2O.
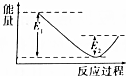
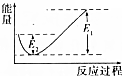
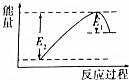
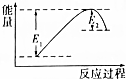
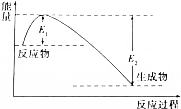 如图所示的是1molNO2和足量的CO完全反应生成CO2和NO过程中的能量变化示意图,能够表示出CO2+NO=NO2+CO的能量变化示意图的是( )
如图所示的是1molNO2和足量的CO完全反应生成CO2和NO过程中的能量变化示意图,能够表示出CO2+NO=NO2+CO的能量变化示意图的是( )