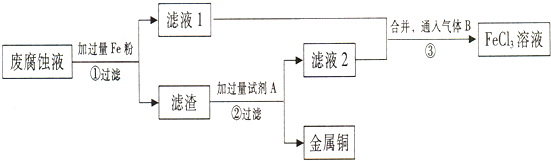
题目内容
2.同温同压下,等质量的O2和CO2相比较,下列叙述正确的是( )| A. | 体积比为8:1 | B. | 分子个数之比为11:12 | ||
| C. | 密度之比为8:11 | D. | 原子个数之比为11:12 |
分析 A.同温同压下,体积之比等于物质的量之比;
B.分子数之比等于物质的量之比;
C.同温同压下,密度之比摩尔质量之比;
D.先求出分子数之比,再根据每个分子中的原子数目计算其原子数目之比.
解答 解:A.设O2和CO2质量都为1g,则V(O2):V(CO2)=n(O2):n(CO2)=$\frac{1g}{32g/mol}$:$\frac{1g}{44g/mol}$=11:8,故A错误;
B.分子数之比等于物质的量之比,由A知n(O2):n(CO2)=$\frac{1g}{32g/mol}$:$\frac{1g}{44g/mol}$=11:8,故B错误;
C.同温同压下,密度之比摩尔质量之比,所以其密度之比为32g/mol:44g/mol=8:11,故C正确;
D.由B知,等质量的O2和CO2的分子数之比为11:8,所以含有原子数目之比为11×2:8×3=11:12,故D正确;
故选CD.
点评 本题考查了阿伏伽德罗定律及推论,题目难度不大,注意借助PV=nRT理解阿伏伽德罗定律及推论,试题有利于提高学生的分析能力及化学计算能力.

练习册系列答案
相关题目
10.已知H2(g)+Cl2(g)═2HCl(g)△H=-184.6KJ•mol-1,则HCl(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g) 的△H 为( )
| A. | +184.6KJ•mol-1 | B. | 92.3KJ•mol-1 | C. | -369.2KJ•mol-1 | D. | +92.3KJ•mol-1 |
7.关于有机物的下列说法,错误的是( )
| A. | 石油裂解能得到乙烯,乙烯是生产聚乙烯的原料 | |
| B. | 甲烷、苯都属于烃,都不存在同分异构体 | |
| C. | 点燃甲烷前一定要检验其纯度 | |
| D. | 煤干馏为化学变化,石油分馏是物理变化 |
11.下列事实不能说明一元酸HA为弱酸的是( )
| A. | 常温下0.1 mol•L-1的HA溶液pH为5 | |
| B. | HA溶液能与大理石反应 | |
| C. | HA溶液中存在H+、OH-、A-、HA | |
| D. | 常温下,向HA溶液的加入NaA固体,溶液的pH增大 |
12.下列不是碳的同素异形体的是( )
| A. | 金刚石 | B. | 石墨 | C. | CO | D. | C60 |