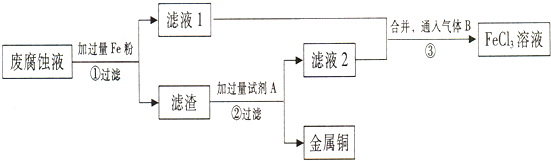
题目内容
1.将0.2mol Mg、Al的混合物用盐酸完全溶解,放出标准状况下5.6L气体,然后再滴入2mol/LNaOH溶液,请回答:(1)求该混合物中Mg、Al的物质的量?(写计算过程)
(2)若该Mg、Al的混合物与盐酸恰好完全反应,在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V=250mL.
分析 (1)镁铝合金与盐酸发生:Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,设合金中Mg为xmol,Al为ymol,则$\left\{\begin{array}{l}{x+y=0.2}\\{x+1.5y=\frac{5.6}{22.4}}\end{array}\right.$,据此计算出Mg、Al的物质的量;
(2)加入NaOH溶液,可发生Mg2++20H-=Mg(OH)2↓、Al3++30H-=Al(OH)3↓,如NaOH过量,则发生Al3++40H-=AlO2-+2H2O,结合反应的离子方程式计算.
解答 解:(1)镁铝合金与盐酸发生:Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,设合金中Mg为xmol,Al为ymol,则$\left\{\begin{array}{l}{x+y=0.2}\\{x+1.5y=\frac{5.6}{22.4}}\end{array}\right.$,解得:$\left\{\begin{array}{l}{x=0.1}\\{y=0.1}\end{array}\right.$,
答:混合物中Mg、Al的物质的量分别为n(Mg)=0.1mol;n(Al)=0.1mol;
(2)若该Mg、Al的混合物与盐酸恰好完全反应,在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,
则发生:Mg2++20H-=Mg(OH)2↓、Al3++30H-=Al(OH)3↓,
则需要n(NaOH)=2n(Mg)+3n(Al)=2×0.1mol+3×0.1mol=0.5mol,
滴入NaOH溶液的体积为:V(NaOH)=$\frac{0.5mol}{2mol/L}$=0.25L=250mL,
故答案为:250.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应、物质的量关系、氢氧化铝的两性等为解答的关键,侧重分析与计算能力的考查,题目难度不大.

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案| A. | CaCl2 | B. | Na2S | C. | H2O | D. | NH4F |
| A. | +184.6KJ•mol-1 | B. | 92.3KJ•mol-1 | C. | -369.2KJ•mol-1 | D. | +92.3KJ•mol-1 |
| A. | 常温下0.1 mol•L-1的HA溶液pH为5 | |
| B. | HA溶液能与大理石反应 | |
| C. | HA溶液中存在H+、OH-、A-、HA | |
| D. | 常温下,向HA溶液的加入NaA固体,溶液的pH增大 |
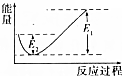
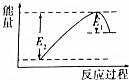
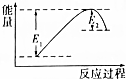
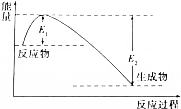 如图所示的是1molNO2和足量的CO完全反应生成CO2和NO过程中的能量变化示意图,能够表示出CO2+NO=NO2+CO的能量变化示意图的是( )
如图所示的是1molNO2和足量的CO完全反应生成CO2和NO过程中的能量变化示意图,能够表示出CO2+NO=NO2+CO的能量变化示意图的是( )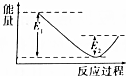






 .
.