题目内容
17.常温下,0.1mol/L氨水溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-8,下列叙述不正确的是( )| A. | 该溶液中氢离子的浓度:c(H+)=1×10-11 mol/L | |
| B. | 0.1 mol/L氨水溶液与0.1 mol/L HCl溶液等体积混合后所得溶液中:c(NH4+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | 0.1 mol/L的氨水溶液与0.05 mol/L H2SO4溶液等体积混合后所得溶液中:c(NH4+)+c(NH3•H2O)=2c(SO42-) | |
| D. | 浓度均为0.1 mol/L的NH3•H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则c(NH4+)>c(NH3•H2O)>c(Cl-)>c(OH-)>c(H+) |
分析 根据溶液中c(H+)与c(OH-)的比值结合溶液的离子积常数Kw计算出溶液的c(H+)和c(OH-),结合溶液中的电荷守恒和物料守恒分析.
解答 解:A.常温下,0.1mol/L氨水溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-8,Kw=c(H+)×c(OH-)=1×10-14,则溶液的c(H+)=1×10-11mol/L,故A正确;
B.0.1 mol/L氨水溶液与0.1 mol/L HCl溶液等体积混合后所得溶液溶质为氯化铵,由电荷守恒可知,c(NH4+)+c(H+)=c(Cl-)+c(OH-),故B正确;
C.0.1 mol/L的氨水溶液与0.05 mol/L H2SO4溶液等体积混合后所得溶液中溶质为(NH4)2SO4,由物料守恒可知c(NH4+)+c(NH3•H2O)=2c(SO42-),故C正确;
D.浓度均为0.1 mol/L的NH3•H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,氨水的电离程度大于铵根离子的水解程度,c(NH3•H2O)<c(Cl-),所以c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+),故D错误;
故选:D.
点评 本题考查酸碱混合后溶液pH的判断和溶液中守恒关系的应用,题目难度中等,本题的关键是根据溶液中c(H+)与c(OH-)的比值,结合溶液的离子积常数Kw计算出溶液的c(H+),注意把握溶液中的物料守恒和电荷守恒.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
(1)催化剂能加快化学反应速率的原因是降低了活化能.
(2)实验①和②的目的是探究浓度对反应速率的影响.实验时由于较长时间没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中).
(3)写出实验③的化学反应方程式2H2O2$\frac{\underline{\;氯化铁\;}}{\;}$2H2O+O2↑.
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.

分析上图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
(2)实验①和②的目的是探究浓度对反应速率的影响.实验时由于较长时间没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中).
(3)写出实验③的化学反应方程式2H2O2$\frac{\underline{\;氯化铁\;}}{\;}$2H2O+O2↑.
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.

分析上图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
8. 研究硫酸工业原理及含硫化合物的性质具有重要意义.
研究硫酸工业原理及含硫化合物的性质具有重要意义.
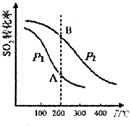
(1)硫酸工业生产中涉及反应:2SO2(g)+O2(g)?2SO3(g)△H<0,SO2的平衡转化率与温度、压强的关系如右图所示,则:
①压强:P1<P2(填“>”、“=”或“<”).
②A、B两点的平衡常数:K(A)=K(B)(填“>”、“=”或“<”).
③200℃时,将一定量的SO2和O2充入容积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
计算上述反应在0~10min内,v(O2)=0.08mol•L-1•min-1mol•L-1•min-1.能说明该反应达到化学平衡状态的是d(填序号).
a.v正(O2)=v逆(SO3) b.SO2和SO3物质的量之和保持不变
c.混合气体的密度保持不变 d.体系的压强保持不变
(2)Cu2S在高温条件下发生如下反应:2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-773kJ•mol-1
当该反应有1.2mol电子转移时,反应释放出的热量为77.3kJ.
(3)某研究小组把钢铁中的硫转化为H2SO3溶液,然后用标准浓度的I2溶液进行滴定,滴定中使用的指示剂为淀粉试液(写名称),滴定过程中c(SO32-)减小(填“增大”、“减小”或“不变”).
(4)利用反应2SO2+O2+2H2O═2H2SO4可以处理SO2尾气,若将该反应设计为原电池,用稀硫酸作电解质溶液,其正极电极反应式为4H++O2+4e-═2H2O.
 研究硫酸工业原理及含硫化合物的性质具有重要意义.
研究硫酸工业原理及含硫化合物的性质具有重要意义.(1)硫酸工业生产中涉及反应:2SO2(g)+O2(g)?2SO3(g)△H<0,SO2的平衡转化率与温度、压强的关系如右图所示,则:
①压强:P1<P2(填“>”、“=”或“<”).
②A、B两点的平衡常数:K(A)=K(B)(填“>”、“=”或“<”).
③200℃时,将一定量的SO2和O2充入容积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
| 气体 | SO2 | O2 | SO3 |
| 浓度(mol•L-1) | 0.4 | 1.2 | 1.6 |
a.v正(O2)=v逆(SO3) b.SO2和SO3物质的量之和保持不变
c.混合气体的密度保持不变 d.体系的压强保持不变
(2)Cu2S在高温条件下发生如下反应:2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-773kJ•mol-1
当该反应有1.2mol电子转移时,反应释放出的热量为77.3kJ.
(3)某研究小组把钢铁中的硫转化为H2SO3溶液,然后用标准浓度的I2溶液进行滴定,滴定中使用的指示剂为淀粉试液(写名称),滴定过程中c(SO32-)减小(填“增大”、“减小”或“不变”).
(4)利用反应2SO2+O2+2H2O═2H2SO4可以处理SO2尾气,若将该反应设计为原电池,用稀硫酸作电解质溶液,其正极电极反应式为4H++O2+4e-═2H2O.
5.下列关于反应能量的说法正确的是( )
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量>生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则含1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
2.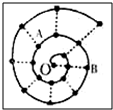 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中正确的是( )
 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中正确的是( )| A. | 离O点越远的元素越容易失去电子 | |
| B. | 虚线相连的元素处于同一周期 | |
| C. | B元素是图中原子半径最大的主族元素 | |
| D. | 元素O和A可形成多种化合物、和B不能形成化合物 |
7.关于有机物的下列说法,错误的是( )
| A. | 石油裂解能得到乙烯,乙烯是生产聚乙烯的原料 | |
| B. | 甲烷、苯都属于烃,都不存在同分异构体 | |
| C. | 点燃甲烷前一定要检验其纯度 | |
| D. | 煤干馏为化学变化,石油分馏是物理变化 |






 .
.