题目内容
某中学学习小组考察过溶洞后,为溶洞中形态各异的石笋和钟乳石而惊叹,决定设计和实施简单的实验--模拟溶洞的“形成”.从教材上查得如下资料:相对原子质量:Ca-40 H-1 O-16
溶洞都分布在石灰岩组成的山地中,石灰岩的主要成分是碳酸钙,当遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:CaCO3+CO2+H2O=Ca(HCO3)2
溶有碳酸氢钙的水遇热或当压强突然变小时,溶解在水里的碳酸氢钙就会分解,重新生成碳酸钙沉积下来,同时放出二氧化碳:Ca(HCO3)2=CaCO3+CO2↑+H2O
洞顶的水在慢慢向下渗透时,水中的碳酸氢钙发生上述反应,有的沉积在洞顶,有的沉积在洞底,日积月累,洞顶的形成钟乳石,洞底的形成石笋,当钟乳石与石笋相连时就形成石柱
(1)他们设计并完成了模拟溶洞“形成”的实验.其实验过程如图1,试回答:实现转化①需要通人足量的气体A,A的化学式是 ;B溶液中溶质的化学式是 ;实现转化②,通常采用的基本操作方法是 .
(2)他们用采集的石灰岩样品进行相关实验.将采集到的样品用水冲洗后晾干,称取20.00g样品平均分成两份,分别与足量相同质量分数的稀盐酸反应进行下列测定(如图2),经数据处理得到释放出二氧化碳的质量与反应时间的关系图(如图3).
①图2所示实验中数据记录纸上应该连续记录的实验数据是 和 .
②由图3中曲线可以看出,固体物质与液体物质反应,当其他条件相同时,接触面积越 ,其反应速率越 .
③试求样品中碳酸钙的质量分数(假设样品中其他杂质不参加反应,不考虑水、氯化氢逸出).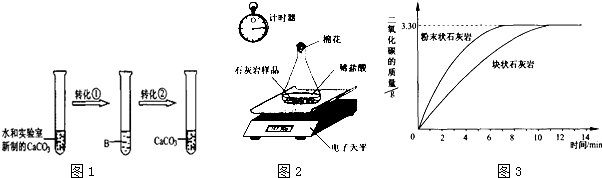
溶洞都分布在石灰岩组成的山地中,石灰岩的主要成分是碳酸钙,当遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:CaCO3+CO2+H2O=Ca(HCO3)2
溶有碳酸氢钙的水遇热或当压强突然变小时,溶解在水里的碳酸氢钙就会分解,重新生成碳酸钙沉积下来,同时放出二氧化碳:Ca(HCO3)2=CaCO3+CO2↑+H2O
洞顶的水在慢慢向下渗透时,水中的碳酸氢钙发生上述反应,有的沉积在洞顶,有的沉积在洞底,日积月累,洞顶的形成钟乳石,洞底的形成石笋,当钟乳石与石笋相连时就形成石柱
(1)他们设计并完成了模拟溶洞“形成”的实验.其实验过程如图1,试回答:实现转化①需要通人足量的气体A,A的化学式是
(2)他们用采集的石灰岩样品进行相关实验.将采集到的样品用水冲洗后晾干,称取20.00g样品平均分成两份,分别与足量相同质量分数的稀盐酸反应进行下列测定(如图2),经数据处理得到释放出二氧化碳的质量与反应时间的关系图(如图3).
①图2所示实验中数据记录纸上应该连续记录的实验数据是
②由图3中曲线可以看出,固体物质与液体物质反应,当其他条件相同时,接触面积越
③试求样品中碳酸钙的质量分数(假设样品中其他杂质不参加反应,不考虑水、氯化氢逸出).

考点:性质实验方案的设计
专题:实验题
分析:(1)由图示的现象和提供的信息,根据CaCO3+CO2+H2O=Ca(HCO3)2、Ca(HCO3)2=CaCO3+CO2↑+H2O分析;
(2)①结合题干、图1和图2中的量,可以得到本小题的答案;
②由图2中的图象对比可以得出本小题的答案;
③由石灰石的质量和图2中所示的二氧化碳的质量,根据碳酸钙与稀盐酸反应的化学方程式可以计算出样品中碳酸钙的质量分数.
(2)①结合题干、图1和图2中的量,可以得到本小题的答案;
②由图2中的图象对比可以得出本小题的答案;
③由石灰石的质量和图2中所示的二氧化碳的质量,根据碳酸钙与稀盐酸反应的化学方程式可以计算出样品中碳酸钙的质量分数.
解答:
解:(1)由图中不溶性的碳酸钙经转化①变成可溶性的,结合题干中的信息“石灰岩的主要成分是碳酸钙,当遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:CaCO3+CO2+H2O═Ca(HCO3)2”可知,气体A是二氧化碳,其化学式为:CO2;
B中的溶质是碳酸氢钙,其化学式为:Ca(HCO3)2;
由图中可溶性的碳酸氢钙经转化②变成不溶性的碳酸钙,结合题干中提供的信息“溶有碳酸氢钙的水遇热或当压强突然变小时,溶解在水里的碳酸氢钙就会分解,重新生成碳酸钙沉积下来,同时放出二氧化碳:Ca(HCO3)2═CaCO3↓+CO2↑+H2O”可知能实现这一转化的方法有加热或减压,两方法中加热是通常采用的基本操作方法,
故答案为:CO2;Ca(HCO3)2;加热;
(2)①结合图2所示的两个量可知图1中实验中数据记录纸上应该连续记录的实验数据是电子天平示数和计时器示数,
故答案为:电子天平示数(或锥形瓶体系质量);计时器示数(或反应时间);
②由图2所示的图象可知:在反应结束前某一温度时,粉末状的石灰岩产生的二氧化碳多,是由于粉末状的石灰岩与稀盐酸的接触面积大,因此反应速率快;块状的石灰岩产生的二氧化碳少,是由于块状的石灰岩与稀盐酸的接触面积小,因此反应速率慢,
故答案为:大;快;
③解:称取20.00g样品平均分成两份,每份的质量为:
=10.00g,
设每份样品中CaCO3的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 3.30g
则:x=
=7.50g,
样品中碳酸钙的质量分数为:
×100%=75.0%,
答:样品中碳酸钙的质量分数为75.0%.
B中的溶质是碳酸氢钙,其化学式为:Ca(HCO3)2;
由图中可溶性的碳酸氢钙经转化②变成不溶性的碳酸钙,结合题干中提供的信息“溶有碳酸氢钙的水遇热或当压强突然变小时,溶解在水里的碳酸氢钙就会分解,重新生成碳酸钙沉积下来,同时放出二氧化碳:Ca(HCO3)2═CaCO3↓+CO2↑+H2O”可知能实现这一转化的方法有加热或减压,两方法中加热是通常采用的基本操作方法,
故答案为:CO2;Ca(HCO3)2;加热;
(2)①结合图2所示的两个量可知图1中实验中数据记录纸上应该连续记录的实验数据是电子天平示数和计时器示数,
故答案为:电子天平示数(或锥形瓶体系质量);计时器示数(或反应时间);
②由图2所示的图象可知:在反应结束前某一温度时,粉末状的石灰岩产生的二氧化碳多,是由于粉末状的石灰岩与稀盐酸的接触面积大,因此反应速率快;块状的石灰岩产生的二氧化碳少,是由于块状的石灰岩与稀盐酸的接触面积小,因此反应速率慢,
故答案为:大;快;
③解:称取20.00g样品平均分成两份,每份的质量为:
| 20.00g |
| 2 |
设每份样品中CaCO3的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 3.30g
则:x=
| 100×3.30g |
| 44 |
样品中碳酸钙的质量分数为:
| 7.50g |
| 10.00 |
答:样品中碳酸钙的质量分数为75.0%.
点评:本题主要考查分析和应用信息解答实际问题的能力、影响反应速率的因素和有关化学方程式的计算,题目难度中等,要结合物质的性质和反应规律进行综合分析,试题侧重考查学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
下列家庭小实验不能制得溶液的是( )
A、 食盐 |
B、 饱和FeCl3溶液 |
C、 蔗糖 |
D、 碘 |
用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、0.1mol的白磷(P4)或四氯化碳(CCl4)中所含的共价键数均为0.4NA |
| B、1L amol/L的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目为3NA |
| C、0.1 molN2和0.3molH2在一定条件下充分反应,转移电子数目为0.6NA |
| D、常温常压下,65gZn与足量浓 H2SO4充分反应,转移电子数一定为2NA |
下列说法正确的是( )
| A、酯化反应、硝化反应以及酯的水解均属于取代反应类型 |
| B、乙醇生成溴乙烷和乙烯生成溴乙烷的反应类型相同 |
| C、可用氢氧化钠溶液除去乙酸乙酯中混有乙酸和乙醇 |
| D、蛋白质、淀粉、油脂均属于天然高分子化合物,均能发生水解反应 |
对于平衡CO2(g)?CO2(aq)△H=-19.75kJ?mol-1,为增大二氧化碳气体在水中的溶解度,应采用的方法是( )
| A、升温增压 | B、降温减压 |
| C、升温减压 | D、降温增压 |
某同学组装了如图所示的电化学装置.电极I为Al,其他电极均为Cu,则( )


| A、工作一段时间后,C烧杯的PH减小 |
| B、电极I发生还原反应 |
| C、盐桥中的K+移向A烧杯 |
D、电流方向:电极Ⅳ→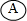 →电极I →电极I |