题目内容
某同学组装了如图所示的电化学装置.电极I为Al,其他电极均为Cu,则( )


| A、工作一段时间后,C烧杯的PH减小 |
| B、电极I发生还原反应 |
| C、盐桥中的K+移向A烧杯 |
D、电流方向:电极Ⅳ→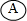 →电极I →电极I |
考点:原电池和电解池的工作原理
专题:
分析:电极Ⅰ为Al,其它均为Cu,Al易失电子作负极,所以Ⅰ是负极、Ⅳ是阴极,Ⅲ是阳极、Ⅱ是正极,电流方向从正极流向负极,负极上失电子发生氧化反应,正极上得电子发生还原反应,据此分析解答.
解答:
解:电极Ⅰ为Al,其它均为Cu,Al易失电子作负极,所以Ⅰ是负极、Ⅳ是阴极,Ⅲ是阳极、Ⅱ是正极,
A.C烧杯是电解池装置,Ⅳ是阴极氢离子得电子放出氢气,而Ⅲ是阳极铜本身失电子生成铜离子,所以电解一段时间后,氢离子减少,碱性增强,故A错误;
B.电极Ⅰ上电极反应式为Al-3e-=Al3+,发生氧化反应,故B错误;
C.Al易失电子作负极,所以Ⅰ是负极、Ⅱ是正极,所以盐桥中的K+移向正极B烧杯,故C错误;
D.电流从正极沿导线流向负极,即电极Ⅳ→A→电极Ⅰ,故D正确;
故选D.
A.C烧杯是电解池装置,Ⅳ是阴极氢离子得电子放出氢气,而Ⅲ是阳极铜本身失电子生成铜离子,所以电解一段时间后,氢离子减少,碱性增强,故A错误;
B.电极Ⅰ上电极反应式为Al-3e-=Al3+,发生氧化反应,故B错误;
C.Al易失电子作负极,所以Ⅰ是负极、Ⅱ是正极,所以盐桥中的K+移向正极B烧杯,故C错误;
D.电流从正极沿导线流向负极,即电极Ⅳ→A→电极Ⅰ,故D正确;
故选D.
点评:本题考查了原电池、电解池原理,正确判断正负极是解本题关键,再结合各个电极上发生的反应来分析解答,题目难度中等.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
在日常生活中会接触到许多物质.下列物质中属于酸性氧化物的是( )
| A、硫酸铵 | B、水 |
| C、二氧化碳 | D、氧化铜 |
下列有关物质性质的说法错误的是( )
| A、热稳定性:HCl>HBr>HI |
| B、原子半径:Na>Mg>Al |
| C、还原性:PH3>H2S>HCl |
| D、结合质子能力:ClO->HCO3->SiO32- |
下列化学方程式或离子方程式中,正确的是( )
A、用浓硫酸与4-溴-1-丁醇加热发生消去反应:BrCH2CH2CH2OH
| |||
B、水杨酸( )中加入NaHCO3溶液: )中加入NaHCO3溶液: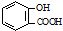 +2HCO3→ +2HCO3→ +2CO2↑+2H2O +2CO2↑+2H2O | |||
| C、在氢氧化钡溶液中滴加硫酸氢钾溶液至pH=7:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |||
| D、用侯氏制碱法制得NaHCO3:Na++NH3+CO2+H2O=NaHCO3↓+NH4+ |
下列实验装置与描述正确的是( )
A、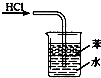 用于吸收HCl气体 |
B、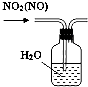 用于除去NO2中的NO |
C、 配制1mol/L NaCl溶液定容操作 |
D、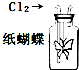 滴有淀粉碘化钾溶液的纸蝴蝶变蓝 |
工业上利用可逆反应N2(g)+3H2(g)?2NH3(g)合成氨,下列叙述正确的是( )
| A、恒温恒压条件下混合气体相对密度不再改变可以说明该反应已经达平衡状态 |
| B、恒容通入氩气,使反应体系的压强增大,反应速率必定增大 |
| C、该反应是放热反应,降低温度将缩短反应达到平衡的时间 |
| D、随着反应的进行,逆反应速率逐渐增大,正反应速率逐渐减小最后为0 |