题目内容
下列家庭小实验不能制得溶液的是( )
A、 食盐 |
B、 饱和FeCl3溶液 |
C、 蔗糖 |
D、 碘 |
考点:分散系、胶体与溶液的概念及关系
专题:
分析:一种或几种物质分散到另一种物质中,形成均一的、稳定的混合物叫做溶液,它的基本特征是均一性和稳定性;根据物质的溶解性分析.
解答:
解:A、食盐易溶于水,形成均一、稳定的混合物,属于溶液,故A不选.
B、饱和FeCl3溶液滴加入沸水中会形成胶体,即不能够形成溶液,故B选.
C、蔗糖易溶于水,形成均一、稳定的混合物,属于溶液,故C不选.
D、碘易溶于酒精,形成均一、稳定的混合物,属于溶液,故D不选.
故选B.
B、饱和FeCl3溶液滴加入沸水中会形成胶体,即不能够形成溶液,故B选.
C、蔗糖易溶于水,形成均一、稳定的混合物,属于溶液,故C不选.
D、碘易溶于酒精,形成均一、稳定的混合物,属于溶液,故D不选.
故选B.
点评:本题考查了物质的溶解性和胶体的制备,解答本题要掌握要掌握溶液的本质特征、各种物质的水溶性方面的知识,只有这样才能对相关方面的问题做出正确的判断,题目难度不大.

练习册系列答案
相关题目
下列对合金描述不正确的是( )
| A、合金最多只能含有两种元素 |
| B、多数合金的硬度较大 |
| C、多数合金的熔点比成分金属低 |
| D、合金的性能跟合金元素的种类有关 |
下列说法不正确的( )
A、一种镁电池的反应式为XMg+Mo3S4
| |||
| B、在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是NH4++Fe3++2SO42-+2Ba2++4OH-=2BaSO4↓+Fe(OH)3↓+NH3?H2O | |||
| C、在甲、乙两个体积不变且相同的密闭容器中发生反应A(g)+2B(g)?2C(g),初始条件均为:常温,A、B两气体各1mol.甲容器中的反应在常温下达平衡,此时气体压强为原来气体压强的80%,乙容器中的反应在200℃时达平衡,若此时气体A的体积分数为35% 则说明该反应是放热反应 | |||
| D、已知:N2(g)+2O2(g)=2NO2(g)△H=+68 kJ?mol-12C(s)+O2(g)=2CO(g)△H=-221 kJ?mol-1C(s)+O2(g)=CO2(g)△H=-393.5 kJ?mol-1则4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=-1200 kJ?mol-1 |
下列化学用语的表达或使用正确的是( )
A、氟离子的结构示意图: |
B、CH4的比例模型: |
C、羧基的电子式: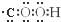 |
| D、NaHCO3的电离方程式:NaHCO3═Na++H++CO32- |
某含Na+的溶液中,可能还存在NH4+、Fe2+、Br-、CO32-、I-、SO42-六种离子中的一种或几种.进行以下实验
由此可以推知该溶液中肯定不存在的离子是( )
①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;
②向橙黄色溶液中加入BaCl2溶液时,无沉淀生成;
③橙黄色溶液不能使淀粉变蓝.
由此可以推知该溶液中肯定不存在的离子是( )
①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;
②向橙黄色溶液中加入BaCl2溶液时,无沉淀生成;
③橙黄色溶液不能使淀粉变蓝.
| A、NH4+、Br-、CO32- |
| B、NH4+、I-、SO42- |
| C、Fe2+、I-、SO42- |
| D、Fe2+、CO32-、I- |
在日常生活中会接触到许多物质.下列物质中属于酸性氧化物的是( )
| A、硫酸铵 | B、水 |
| C、二氧化碳 | D、氧化铜 |