题目内容
“碘钟”实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃进行实验,得到的数据如下表:
回答下列问题:
(1)该实验的目的是 .
(2)t1是
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃条件下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母).
A.<22.0s B.22.0~44.0s C.>44.0s D.数据不足,无法判断.
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol?L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| c(S2O82-)/mol?L-1 | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
(1)该实验的目的是
(2)t1是
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃条件下进行编号③对应浓度的实验,显色时间t2的范围为
A.<22.0s B.22.0~44.0s C.>44.0s D.数据不足,无法判断.
考点:探究影响化学反应速率的因素
专题:实验设计题
分析:该题图表的分析方法:先比较两组数据的不同点,再分析不同点说明的问题,从而确定它们之间关系.
如:①、②两组数据的不同点是c(I-)和时间,浓度越大,时间越短,浓度的变化量与时间的比值为速率,所以浓度越大,反应速率越快.
(1)根据图表已知物理量判断;
(2)根据浓度与时间的关系计算;
(3)根据温度与反应速率的关系判断;
如:①、②两组数据的不同点是c(I-)和时间,浓度越大,时间越短,浓度的变化量与时间的比值为速率,所以浓度越大,反应速率越快.
(1)根据图表已知物理量判断;
(2)根据浓度与时间的关系计算;
(3)根据温度与反应速率的关系判断;
解答:
解:(1)图表中的物理量是反应物浓度与时间,通过分析知,反应物的浓度与时间成反比,浓度的变化量与时间的比值为速率,所以得出反应物浓度与反应速率的关系.
故答案为:研究反应物I-与S2O82-的浓度对反应速率的影响;
(2)通过分析各组数据知,反应物起始浓度乘积与时间成反比,由①、⑤列比例式,
(0.040 mol?L-1×0.040mol?L-1):(0.120 mol?L-1×0.040mol?L-1)=t1:88.0s,所以t1=29.3 s
故答案为:29.3 s
(3)温度越高,化学反应速率越快,所用时间越短,故选A.
故答案为:研究反应物I-与S2O82-的浓度对反应速率的影响;
(2)通过分析各组数据知,反应物起始浓度乘积与时间成反比,由①、⑤列比例式,
(0.040 mol?L-1×0.040mol?L-1):(0.120 mol?L-1×0.040mol?L-1)=t1:88.0s,所以t1=29.3 s
故答案为:29.3 s
(3)温度越高,化学反应速率越快,所用时间越短,故选A.
点评:本题通过图表考查反应物浓度与反应速率的关系,解答的关键是通过数据找出规律.

练习册系列答案
相关题目
下列实验装置与描述正确的是( )
A、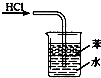 用于吸收HCl气体 |
B、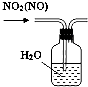 用于除去NO2中的NO |
C、 配制1mol/L NaCl溶液定容操作 |
D、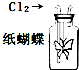 滴有淀粉碘化钾溶液的纸蝴蝶变蓝 |
下列有关事实的叙述正确的是( )
| A、电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 |
| B、玻璃钢、航天飞机上的隔热陶瓷瓦都属于复合材料 |
| C、氧化钠可作为呼吸面具和潜水艇里氧气的来源 |
| D、铝-空气燃料电池通常以NaOH溶液为电解液,电池在工作过程中电解液的pH保持不变 |
下列关于粗盐提纯说法正确的是( )
| A、溶解粗盐时,应尽量使溶液稀些,以保证食盐完全溶解 |
| B、滤去不溶性杂质以后,将滤液移至坩埚内加热浓缩 |
| C、当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干 |
| D、将制得的晶体转移到新制过滤器中用大量蒸馏水进行洗涤 |
工业上利用可逆反应N2(g)+3H2(g)?2NH3(g)合成氨,下列叙述正确的是( )
| A、恒温恒压条件下混合气体相对密度不再改变可以说明该反应已经达平衡状态 |
| B、恒容通入氩气,使反应体系的压强增大,反应速率必定增大 |
| C、该反应是放热反应,降低温度将缩短反应达到平衡的时间 |
| D、随着反应的进行,逆反应速率逐渐增大,正反应速率逐渐减小最后为0 |
下列说法正确的是( )
A、.已知
| ||||||||||||||||||||||||||
| B、已知:25℃时,CaCO3的Ksp为2.9×10-9,CaF2的Ksp为2.7×10-11在CaCO3悬浊液中加入NaF固体,CaCO3不可能全转化为CaF2 | ||||||||||||||||||||||||||
C、常温下
| ||||||||||||||||||||||||||
D、由下列短周期元素性质的数据推断元素⑤最高价氧化物对应的水化物酸性最强
|