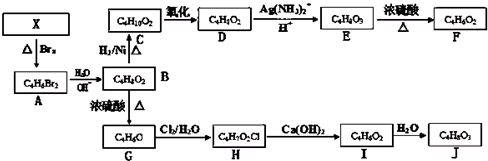
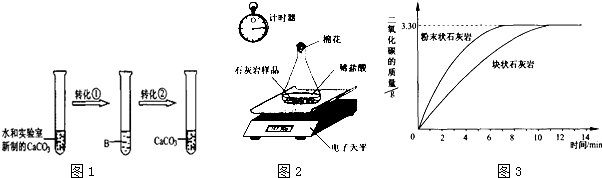
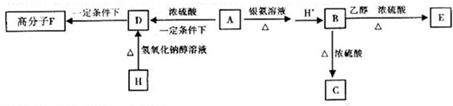
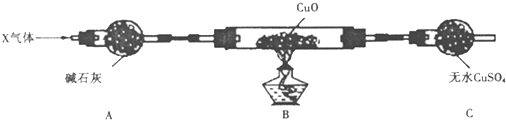
题目内容
用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、0.1mol的白磷(P4)或四氯化碳(CCl4)中所含的共价键数均为0.4NA |
| B、1L amol/L的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目为3NA |
| C、0.1 molN2和0.3molH2在一定条件下充分反应,转移电子数目为0.6NA |
| D、常温常压下,65gZn与足量浓 H2SO4充分反应,转移电子数一定为2NA |
考点:阿伏加德罗常数
专题:
分析:A.1mol白磷含有6mol的P-P键;
B.三价铁离子为弱碱阳离子,部分水解生成氢氧化铁;
C.氮气与氢气合成氨气为可逆反应,可逆反应不能进行到底;
D.锌与足量浓硫酸反应的方程式:Zn+2H2SO4(浓)=ZnS04+SO2↑+2H2O,Zn→Zn2+,1mol锌参加反应失去2mol电子,据此解答.
B.三价铁离子为弱碱阳离子,部分水解生成氢氧化铁;
C.氮气与氢气合成氨气为可逆反应,可逆反应不能进行到底;
D.锌与足量浓硫酸反应的方程式:Zn+2H2SO4(浓)=ZnS04+SO2↑+2H2O,Zn→Zn2+,1mol锌参加反应失去2mol电子,据此解答.
解答:
解:A.1mol白磷含有6mol的P-P键,所以0.1mol白磷中共价键数为0.6NA,故A错误;
B.1L amol/L的氯化铁溶液中,铁离子发生了水解,导致三价铁离子数目减小,若Fe3+的数目为NA,则Cl-的数目大于3NA,故B错误;
C.在密闭容器中,0.1molN2与0.3molH2在一定条件下充分反应,反应是可逆反应,不能进行完全,生成氨气的分子数小于0.2mol,转移电子数目小于0.6NA,故C错误;
D.65gZn的物质的量为1mol,与浓硫酸反应:Zn+2H2SO4(浓)=ZnS04+SO2↑+2H2O,Zn→Zn2+,1mol锌参加反应失去2mol电子,所以65gZn与足量浓 H2SO4充分反应,转移电子数一定为2NA,故D正确;
故选:D.
B.1L amol/L的氯化铁溶液中,铁离子发生了水解,导致三价铁离子数目减小,若Fe3+的数目为NA,则Cl-的数目大于3NA,故B错误;
C.在密闭容器中,0.1molN2与0.3molH2在一定条件下充分反应,反应是可逆反应,不能进行完全,生成氨气的分子数小于0.2mol,转移电子数目小于0.6NA,故C错误;
D.65gZn的物质的量为1mol,与浓硫酸反应:Zn+2H2SO4(浓)=ZnS04+SO2↑+2H2O,Zn→Zn2+,1mol锌参加反应失去2mol电子,所以65gZn与足量浓 H2SO4充分反应,转移电子数一定为2NA,故D正确;
故选:D.
点评:本题考查了阿伏伽德罗常数,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意盐类的水解和可逆反应的特点,题目难度不大.

练习册系列答案
相关题目
下列说法不正确的( )
A、一种镁电池的反应式为XMg+Mo3S4
| |||
| B、在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是NH4++Fe3++2SO42-+2Ba2++4OH-=2BaSO4↓+Fe(OH)3↓+NH3?H2O | |||
| C、在甲、乙两个体积不变且相同的密闭容器中发生反应A(g)+2B(g)?2C(g),初始条件均为:常温,A、B两气体各1mol.甲容器中的反应在常温下达平衡,此时气体压强为原来气体压强的80%,乙容器中的反应在200℃时达平衡,若此时气体A的体积分数为35% 则说明该反应是放热反应 | |||
| D、已知:N2(g)+2O2(g)=2NO2(g)△H=+68 kJ?mol-12C(s)+O2(g)=2CO(g)△H=-221 kJ?mol-1C(s)+O2(g)=CO2(g)△H=-393.5 kJ?mol-1则4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=-1200 kJ?mol-1 |