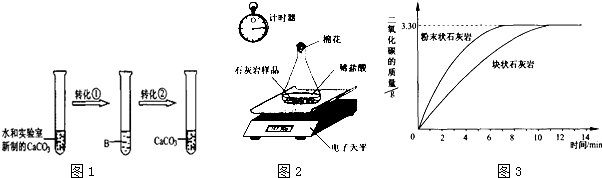
题目内容
对于平衡CO2(g)?CO2(aq)△H=-19.75kJ?mol-1,为增大二氧化碳气体在水中的溶解度,应采用的方法是( )
| A、升温增压 | B、降温减压 |
| C、升温减压 | D、降温增压 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:为了减小温室效应的产生,增大二氧化碳气体在水中的溶解度,应使平衡向正反应方向移动,注意温度和压强对平衡移动的影响.
解答:
解:对平衡体系CO2 (g)?CO2(aq)△H=-19.75kJ?mol-1,该反应放热,为增大二氧化碳气体在水中的溶解度,应降低温度,增大压强,可使平衡向正反应方向移动,所以为了减小温室效应的产生,增大二氧化碳气体在水中的溶解度,应降温增压,
故选D.
故选D.
点评:本题考查外界条件对平衡移动的影响,题目难度不大,注意把握影响平衡的移动的因素.

练习册系列答案
相关题目
某含Na+的溶液中,可能还存在NH4+、Fe2+、Br-、CO32-、I-、SO42-六种离子中的一种或几种.进行以下实验
由此可以推知该溶液中肯定不存在的离子是( )
①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;
②向橙黄色溶液中加入BaCl2溶液时,无沉淀生成;
③橙黄色溶液不能使淀粉变蓝.
由此可以推知该溶液中肯定不存在的离子是( )
①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;
②向橙黄色溶液中加入BaCl2溶液时,无沉淀生成;
③橙黄色溶液不能使淀粉变蓝.
| A、NH4+、Br-、CO32- |
| B、NH4+、I-、SO42- |
| C、Fe2+、I-、SO42- |
| D、Fe2+、CO32-、I- |
下列有关物质性质的说法错误的是( )
| A、热稳定性:HCl>HBr>HI |
| B、原子半径:Na>Mg>Al |
| C、还原性:PH3>H2S>HCl |
| D、结合质子能力:ClO->HCO3->SiO32- |
下列实验装置与描述正确的是( )
A、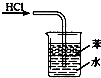 用于吸收HCl气体 |
B、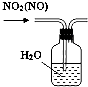 用于除去NO2中的NO |
C、 配制1mol/L NaCl溶液定容操作 |
D、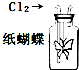 滴有淀粉碘化钾溶液的纸蝴蝶变蓝 |
下列关于粗盐提纯说法正确的是( )
| A、溶解粗盐时,应尽量使溶液稀些,以保证食盐完全溶解 |
| B、滤去不溶性杂质以后,将滤液移至坩埚内加热浓缩 |
| C、当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干 |
| D、将制得的晶体转移到新制过滤器中用大量蒸馏水进行洗涤 |