题目内容
5.25℃时,用浓度为0.10mol•L-1的氢氧化钠溶液分别滴定20.00mL,浓度均为0.10二种酸HX、HY(忽略体积变化),实验数据如下表,下列判断正确的是( )数据编号 | 加入NaOH溶液的体积/mL | 溶液的pH | ||
| C(HX) | c(HY) | |||
| ① | 0 | 4 | 1 | |
| ② | a | 7 | ||
| ③ | 20.00 | x | y | |
| A. | 由表中数据可估算出25℃时Ka(HX)≈10-8 | |
| B. | 在相同温度下,物质的量浓度相同的两种酸溶液的导电能力为HX<HY | |
| C. | 编号②反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+) | |
| D. | 编号③反应的溶液中:c(X-)>c(Y-) |
分析 A.根据Ka(HX)=$\frac{c({H}^{+})•c({X}^{-})}{c(HX)}$计算;
B.根据表中数据分析,0.1000mol•L-1的酸HX、HY的pH分别为4、1,可知HX为弱酸、HY为强酸,同浓度的两种酸溶液的导电能力顺序HX<HY;
C.HY为强酸,与氢氧化钠反应时HY酸过量,溶液显酸性,c(H+)>c(OH-);
D.③中氢氧化钠与HX、HY恰好完全反应生成NaX、NaY,X-部分水解,Y-不水解.
解答 解:A.0.100mol/L的二种酸HX溶液的pH=4,c(H+)=c(X-)=10-4,Ka(HX)=$\frac{c({H}^{+})•c({X}^{-})}{c(HX)}$=$\frac{1{0}^{-4}×1{0}^{-4}}{0.1}$=10-8,故A正确;
B.0.1000mol•L-1的酸HX、HY的pH分别为4、1,HX为弱酸、HY为强酸,同浓度的两种酸溶液的导电能力顺序HX<HY,故B正确;
C.上述②反应后的HX溶液显中性,因为HX为弱酸、HY为强酸,则氢氧化钠溶液体积小于酸溶液体积,则HY酸过量,反应后溶液中c(H+)>c(OH-),故C错误;
D.编号③反应的溶液中溶质分别为等浓度的NaX、NaY,X-部分水解,Y-不水解,则c(X-)<c(Y-),故D错误;
故选AB.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握电离平衡常数的概念及计算方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
13.有关物质结构的下列说法中正确的是( )
| A. | 石油裂解只破坏极性键 | |
| B. | 含极性键的共价化合物一定是电解质 | |
| C. | 氯化钠固体中的离子键在溶于水时被破坏 | |
| D. | HF的分子间作用力大于HCl,故HF比HCl稳定 |
17.向BaCl2溶液中通入SO2气体,溶液仍澄清;若将BaCl2溶液分盛两支试管,一支中加入H2O2,另一支中加入烧碱溶液,然后再通入SO2气体,结果两支试管都有白色沉淀生成.由此得出的下列结论合理的是( )
| A. | 氯化钡有两性 | |
| B. | 两支试管中产生的沉淀都是BaSO4 | |
| C. | 两支试管中的沉淀都是BaSO3 | |
| D. | H2SO3可被H2O2氧化为H2SO4,BaCl2与SO2不反应但能与SO${\;}_{3}^{2-}$反应 |
14.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的是( )
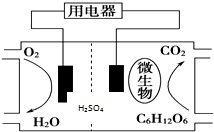

| A. | 葡萄糖在正极失去电子被氧化成CO2 | |
| B. | 微生物的作用是促进电路中电子的转移 | |
| C. | 质子通过交换膜从正极移向负极区 | |
| D. | 正极的电极反应式为O2+4H++4e-═2H2O |
16.下列变化中属于原电池反应的是( )
| A. | 白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化 | |
| B. | 在空气中金属铝表面迅速被氧化形成保护膜 | |
| C. | 红热的铁丝与水接触表面形成蓝色保护层 | |
| D. | 在铁与稀H2SO4反应时,改用铁粉,可加快H2的产生 |
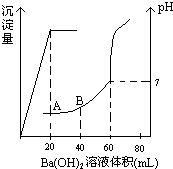 有稀硫酸和稀盐酸的混合液10mL,在此溶液中滴入0.25mol.L-1氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如图所示.求:
有稀硫酸和稀盐酸的混合液10mL,在此溶液中滴入0.25mol.L-1氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如图所示.求: