题目内容
14.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的是( )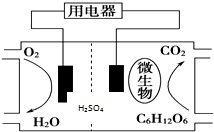
| A. | 葡萄糖在正极失去电子被氧化成CO2 | |
| B. | 微生物的作用是促进电路中电子的转移 | |
| C. | 质子通过交换膜从正极移向负极区 | |
| D. | 正极的电极反应式为O2+4H++4e-═2H2O |
分析 根据图知,该原电池中,C元素化合价由0价变为+4价,所以葡萄糖失电子发生氧化反应,则含有葡萄糖的电极是分解、通入氧气的电极是正极;
A.失电子的物质被氧化;
B.在微生物的作用微生物作用下,该装置为原电池装置,原电池能加快反应速率;
C.电解质溶液中质子向正极移动;
D.正极上氧气得电子和氢离子反应生成水.
解答 解:根据图知,该原电池中,C元素化合价由0价变为+4价,所以葡萄糖失电子发生氧化反应,则含有葡萄糖的电极是分解、通入氧气的电极是正极;
A.失电子的物质被氧化,葡萄糖失电子被氧化生成二氧化碳,在负极上发生氧化反应,故A错误;
B.在微生物的作用微生物作用下,该装置为原电池装置,原电池能加快反应速率,所以可以说微生物的作用是促进电路中电子的转移,故B正确;
C.电解质溶液中质子向正极移动,所以质子通过交换膜从负极移向正极区,故C错误;
D.正极上氧气得电子和氢离子反应生成水,电极反应式为O2+4H++4e-═2H2O,故D正确;
故选BD.
点评 本题考查化学电源新型电池,为高频考点,明确正负极判断与元素化合价变化关系是解本题关键,难点是电极反应式的书写,题目难度不大.

练习册系列答案
相关题目
5.25℃时,用浓度为0.10mol•L-1的氢氧化钠溶液分别滴定20.00mL,浓度均为0.10二种酸HX、HY(忽略体积变化),实验数据如下表,下列判断正确的是( )
数据编号 | 加入NaOH溶液的体积/mL | 溶液的pH | ||
| C(HX) | c(HY) | |||
| ① | 0 | 4 | 1 | |
| ② | a | 7 | ||
| ③ | 20.00 | x | y | |
| A. | 由表中数据可估算出25℃时Ka(HX)≈10-8 | |
| B. | 在相同温度下,物质的量浓度相同的两种酸溶液的导电能力为HX<HY | |
| C. | 编号②反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+) | |
| D. | 编号③反应的溶液中:c(X-)>c(Y-) |
2.下列混合物完全燃烧生成CO2的量可能与燃烧等物质的量的乙烯生成CO2的量相等的是( )
| A. | C2H6O和C3H8 | B. | CH4和C3H6 | C. | C3H6和C3H8 | D. | CH4和C2H2 |
7.根据元素周期表和元素周期律分析下面的推断,其中不正确的是( )
| A. | 氢氧化镭[Ra(OH2)]比氢氧化钙的碱性强 | |
| B. | 砹(At)的单质颜色为黑色 | |
| C. | 铍(Be)的原子失电子能力比镁弱 | |
| D. | 硒(Se)化氢比硫化氢稳定 |
5.0.02mol•L-1的HCN溶液与0.02mol•L-1的NaCN溶液等体积混合,已知混合液中[CN-]<[Na+],则下列关系正确的是( )
| A. | c(Na+)>c(CN-)>c(OH-)>c(H+) | B. | c(HCN)+(CN-)=0.04 mol•L-1 | ||
| C. | c(Na+)+c (OH-)=c(CN-)+c(H+) | D. | c(CN-)>c(HCN) |
 .
.